题目内容
3.25g锌可以跟100g稀盐酸恰好完全反应,计算:
(1)可制得氢气多少克?(2)这种稀盐酸中溶质质量分数是多少?
解:设可制得H2的质量为x,稀HCl溶质质量为y.
Zn+2HCl═ZnCl2+H2↑
65 73 2
3.25g y x
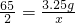
x=0.1g

y=3.65g
 %=3.65%
%=3.65%
答:(1)可制得氢气0.1g.(2)稀盐酸中溶质质量分数是3.65%
分析:(1)利用锌与盐酸反应的化学方程式,根据锌的质量求出氢气的质量.
(2)根据锌的质量求出稀盐酸中溶质的质量,再根据 %求出稀盐酸中溶质的质量分数.
%求出稀盐酸中溶质的质量分数.
点评:本道题目比较简单,是一道最基本的根据化学方程式的计算题,需要注意的是稀盐酸是混合物,稀盐酸的质量不能代入化学方程式进行计算.
Zn+2HCl═ZnCl2+H2↑
65 73 2
3.25g y x
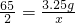
x=0.1g

y=3.65g
 %=3.65%
%=3.65%答:(1)可制得氢气0.1g.(2)稀盐酸中溶质质量分数是3.65%
分析:(1)利用锌与盐酸反应的化学方程式,根据锌的质量求出氢气的质量.
(2)根据锌的质量求出稀盐酸中溶质的质量,再根据
 %求出稀盐酸中溶质的质量分数.
%求出稀盐酸中溶质的质量分数.点评:本道题目比较简单,是一道最基本的根据化学方程式的计算题,需要注意的是稀盐酸是混合物,稀盐酸的质量不能代入化学方程式进行计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目