题目内容
5.某校科学兴趣小组利用木炭做还原剂使木炭与氧化铜进行,发现很难观察到紫红色铜的生成,却往往有暗红色固体出现Cu2O.小明认为碳和氧化铜反应需要较高温度,建议用乙装置代替甲装置,即用酒精喷灯替代酒精灯.并添加了止水夹,在实验结束时及时夹上.针对上述实验,回答下列问题: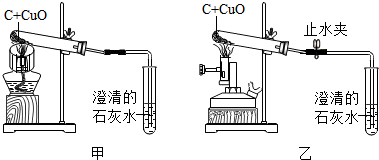
(1)碳和氧化铜反应前需要先进行气密性检查,方法是将导管伸入水中,用酒精灯加热试管底部,观察导管口是否出现气泡.
(2)稍过量的炭粉有利于反应的进行,对下列三种氧化铜和碳的质量比例,建议选择A.
A.32:3 B.40:3 C.48:3
(3)该小组按改进后的方案进行实验(图乙),待反应结束,先将导气管从石灰水中取出,然后关闭止水夹,让产物自然冷却,终于获得了紫红色铜.若不关闭止水夹,可能出现的问题是水倒流入试管,使试管受热不均匀而破裂.
分析 (1)根据检查装置气密性的方法分析回答;
(2)根据碳与氧化铜的反应分析回答;
(3)根据实验的注意事项分析回答.
解答 解:(1)碳和氧化铜反应前需要先进行气密性检查,方法是将导管伸入水中,用酒精灯加热试管底部,观察导管口是否出现气泡;
(2)在选择氧化铜和碳的质量比例时要考虑到氧气消耗的炭,不能按反应的比例选择,碳粉要稍多一些,有利于反应充分进行.
2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑
160 12即40:3,而碳粉稍微多一点,即在给定选项中选A.
(3)该小组按改进后的方案进行实验(图乙),待反应结束,先将导气管从石灰水中取出,然后关闭止水夹,让产物自然冷却,终于获得了紫红色铜.若不关闭止水夹,可能出现的问题是水倒流入试管,使试管受热不均匀而破裂.
故答为:(1)将导管伸入水中,用酒精灯加热试管底部,观察导管口是否出现气泡;
(2)A;
(3)水倒流入试管,使试管受热不均匀而破裂.
点评 完成实验探究题时,要明确探究的目的,根据所给信息按步骤进行分析,认真思考反应中的现象,不放过细节问题.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
16.“鱼浮灵”主要成分是过碳酸钠(xNa2CO3•yH2O2),俗称固体双氧水.兴趣小组对其进行以下探究:
【性质探究】
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡.将带火星木条伸入试管,木条复燃,说明有O2生成.
(2)取实验(1)中上层清液,测得溶液pH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有二氧化碳生成.
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质.
【工业制备】
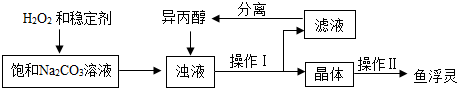
注:异丙醇为有机溶剂.
(3)稳定剂的作用是防止过碳酸钠分解;稳定剂中MgCl2和Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为MgCl2+Na2SiO3=MgSiO3↓+2NaCl.
(4)浊液中加入异丙醇的作用是减少过碳酸钠的溶解.
(5)操作Ⅱ中洗涤晶体的试剂最好选用C(填字母).
A.饱和NaCl溶液 B水 C异丙醇 D稀盐酸
(6)根据下表数据,你认为上述制备反应的最佳温度范围是15~20℃.
注:活性氧含量是指产品中能转化为O2的氧元素的质量分数.
【组成测定】利用下图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响).
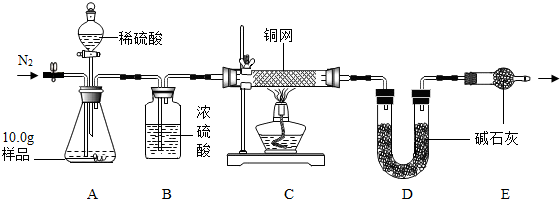
查阅资料:①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品.
②过碳酸钠能与酸反应放出CO2和O2.
(7)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是实验前通氮气是为了除去装置内的空气,以防测定值偏高;实验后还要继续通氮气是为了使残留在装置中的气体全部被吸收.
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值偏大(填“偏大”或“偏小”).
(9)装置B的作用是①②(填序号)
①除去气体中的水蒸气 ②便于观察和控制气流速度
(10)实验测得C装置中铜网增重1.2g,D装置增重2.2g.该产品中活性氧含量为12%%;属于合格品(填“一等品”或“合格品”);x:y=2:3.
【性质探究】
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡.将带火星木条伸入试管,木条复燃,说明有O2生成.
(2)取实验(1)中上层清液,测得溶液pH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有二氧化碳生成.
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质.
【工业制备】

注:异丙醇为有机溶剂.
(3)稳定剂的作用是防止过碳酸钠分解;稳定剂中MgCl2和Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为MgCl2+Na2SiO3=MgSiO3↓+2NaCl.
(4)浊液中加入异丙醇的作用是减少过碳酸钠的溶解.
(5)操作Ⅱ中洗涤晶体的试剂最好选用C(填字母).
A.饱和NaCl溶液 B水 C异丙醇 D稀盐酸
(6)根据下表数据,你认为上述制备反应的最佳温度范围是15~20℃.
| 温度范围/℃ | 5~10 | 10~15 | 15~20 | 20~25 |
| 活性氧含量/% | 13.94 | 14.02 | 15.05 | 14.46 |
| “鱼浮灵”的产率/% | 85.49 | 85.78 | 88.38 | 83.01 |
【组成测定】利用下图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定(杂质对测定无影响).

查阅资料:①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品.
②过碳酸钠能与酸反应放出CO2和O2.
(7)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2,其目的是实验前通氮气是为了除去装置内的空气,以防测定值偏高;实验后还要继续通氮气是为了使残留在装置中的气体全部被吸收.
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值偏大(填“偏大”或“偏小”).
(9)装置B的作用是①②(填序号)
①除去气体中的水蒸气 ②便于观察和控制气流速度
(10)实验测得C装置中铜网增重1.2g,D装置增重2.2g.该产品中活性氧含量为12%%;属于合格品(填“一等品”或“合格品”);x:y=2:3.
13.初中化学课上,同学们利用下列图1装置实验探究碱的化学性质:
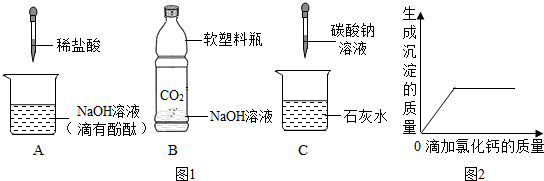
(1)B实验中反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
(2)C实验中观察到的现象是澄清石灰水变浑浊.
(3)实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色.
【提出问题】废液中含有什么物质?
【假设猜想】通过分析上述实验,同学们猜想:废液中除酚酞和水外一定含有NaCl.
老师问:废液中还可能有什么物质?某同学脱口而出:废液中含有氢氧化钠,他的说法正确吗?同学们认为不准确,理由是:Ca(OH)2、Na2CO3溶液也可使酚酞试液变红.于是引发了热烈讨论,下面是大家的发言:
【查阅资料】CaCl2+Na2CO3═CaCO3↓+2NaCl
( 4 )【实验验证】同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钙溶液,根据反应现象绘制了如图2所示的示意图.
①【结论解释】分析图象数据得出可能含有的物质中,一定含有Na2CO3,
②【拓展提高】那么是否含有氢氧化钠呢?请你帮他继续完成实验,写出探究的实验方法:由于本身混有酚酞,所以可以观察沉淀后的溶液的颜色,若溶液变红,则含有NaOH;若溶液不变色,则不含NaOH.

(1)B实验中反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
(2)C实验中观察到的现象是澄清石灰水变浑浊.
(3)实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色.
【提出问题】废液中含有什么物质?
【假设猜想】通过分析上述实验,同学们猜想:废液中除酚酞和水外一定含有NaCl.
老师问:废液中还可能有什么物质?某同学脱口而出:废液中含有氢氧化钠,他的说法正确吗?同学们认为不准确,理由是:Ca(OH)2、Na2CO3溶液也可使酚酞试液变红.于是引发了热烈讨论,下面是大家的发言:
| 学生甲 | 还可能有Ca(OH)2、NaOH | 学生丙 | 还可能有Ca(OH)2、CaCl2 |
| 学生乙 | 还可能有NaOH、Na2CO3 | 学生丁 | 还可能有Na2CO3 |
| … | … |
( 4 )【实验验证】同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钙溶液,根据反应现象绘制了如图2所示的示意图.
①【结论解释】分析图象数据得出可能含有的物质中,一定含有Na2CO3,
②【拓展提高】那么是否含有氢氧化钠呢?请你帮他继续完成实验,写出探究的实验方法:由于本身混有酚酞,所以可以观察沉淀后的溶液的颜色,若溶液变红,则含有NaOH;若溶液不变色,则不含NaOH.
20.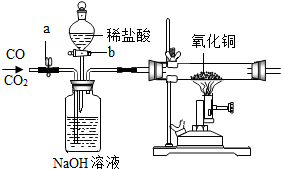 现有CO、CO2混合气体,某同学按顺序进行操作:①关b开a;②通入混合气体;③收集气体;④关a开b;⑤收集气体.通过上述操作这位同学收集到气体为( )
现有CO、CO2混合气体,某同学按顺序进行操作:①关b开a;②通入混合气体;③收集气体;④关a开b;⑤收集气体.通过上述操作这位同学收集到气体为( )
 现有CO、CO2混合气体,某同学按顺序进行操作:①关b开a;②通入混合气体;③收集气体;④关a开b;⑤收集气体.通过上述操作这位同学收集到气体为( )
现有CO、CO2混合气体,某同学按顺序进行操作:①关b开a;②通入混合气体;③收集气体;④关a开b;⑤收集气体.通过上述操作这位同学收集到气体为( )| A. | 只收集到CO气体 | B. | 只收集到CO2气体 | ||
| C. | 先收集到CO气体,后收集到CO2气体 | D. | 先收集到CO2气体,后收集到CO气体 |
17.同学们用Na2CO3溶液和浓盐酸来研究简易灭火器的反应原理时,对反应后废液的成分进行探究.上述两种物质发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑,由此判断废液中溶质一定有NaCl(NaCl溶液呈中性),设计一个简单的实验确定废液中另一成分是Na2CO3还是盐酸.
(1)用向废液中逐滴加入经过酸化的AgNO3溶液来确定废液中另一成分是Na2CO3还是盐酸,此方法不可行的原因NaCl+AgNO3═AgCl↓+NaNO3(用化学方程式说明).
(2)后续实验操作是玻璃棒蘸起废液涂在PH试纸上,再与比色卡对照测出废液的pH大于7,确定废液中一定含有Na2CO3.
(3)欲从废液中得到纯净的NaCl,请完成右表格实验方案设计.
(1)用向废液中逐滴加入经过酸化的AgNO3溶液来确定废液中另一成分是Na2CO3还是盐酸,此方法不可行的原因NaCl+AgNO3═AgCl↓+NaNO3(用化学方程式说明).
| 方案 | 加入试剂 | 分离方法 | 方案评价 |
| 1 | 适量Ca(NO3)2溶液 | 过滤、蒸发、结晶 | 不可行,理由是引入了新杂质硝酸钠 |
| 2 | 过量的稀盐酸 | 蒸发结晶 | 可行 |
(3)欲从废液中得到纯净的NaCl,请完成右表格实验方案设计.
19.甲.乙两种化合物都只含X.Y两种元素,甲.乙中X元素的质量分数分别为a%和b%(a%<b%).已知甲的化学式为XY,则乙的化学式可能为( )
| A. | X2Y | B. | XY2 | C. | X2Y3 | D. | X2Y5 |