题目内容
16.有一包白色粉末,可能是AgCl、Na2CO3、Mg(OH)2、BaCl2、Na2SO4、NaNO3中的一种或几种物质,现做如下实验:(1)将少量粉末放在烧杯中加足量的水,搅拌、静置、过滤,得无色溶液和白色沉淀.
(2)向过滤所得沉淀中加足量稀硝酸,沉淀全部溶解且无气体产生.
判断此包物质中一定有Mg(OH)2,一定没有AgCl,不能肯定是否含有的物质是NaNO3、Na2CO3、BaCl2、Na2SO4.
分析 根据BaCl2和Na2SO4、Na2CO3反应产生硫酸钡沉淀、碳酸钡沉淀,AgCl、Mg(OH)2是难溶性的物质,而硫酸钡不溶于酸,碳酸钡溶于酸产生气泡,氢氧化镁能够和酸反应对沉淀做出判断,据此进行分析.
解答 解:把白色粉末溶解后得无色溶液和白色沉淀,白色沉淀可能是氢氧化镁,也可能是氯化银,也可能是硫酸钠、碳酸钠与氯化钡反应后生成的硫酸钡沉淀、碳酸钡沉淀,其中氢氧化镁和碳酸钡能够溶于酸,而硫酸钡、氯化银不溶于酸,而题目中的白色沉淀全部溶于稀硝酸中且没有产生气泡,说明一定含有沉淀氢氧化镁,这种白色沉淀肯定不含有氯化银、硫酸钡和碳酸钡,因此由分析知该白色固体中一定含有Mg(OH)2,一定不含有AgCl,碳酸钠、硫酸钠和氯化钡不能共存,因此可能含有碳酸钠、硫酸钠或氯化钡中的一种,或都不含有,因此不能确定;另外也可能含有对实验现象没有影响的NaNO3;
故答案为:Mg(OH)2;AgCl;NaNO3、Na2CO3、BaCl2、Na2SO4.
点评 本题为推断题对于推断题的解法,要根据题给条件和物质的化学特性找准突破口,然后顺藤摸瓜尽可能的把没有组合写出,然后进行解答.

练习册系列答案
相关题目
7.下列区别两种不同物质的方法合理的是( )
| A. | 用蒸馏水区别四氧化三铁与二氧化锰 | |
| B. | 用酚酞试液区别氯化钠溶液与稀硫酸 | |
| C. | 用二氧化碳区别稀烧碱溶液与石灰水 | |
| D. | 用加碱的方法区别氯化铵与氯化钠 |
4.为测定煅烧一段时间后的石灰石(成分为碳酸钙和氧化钙及15%的不含钙的杂质)中钙元素的质量分数,某同学取l00g该石灰石继续煅烧,充分反应后,称量剩余固体的质量为78g,则该石灰石中钙元素的质量分数为( )
| A. | 35% | B. | 45% | C. | 55% | D. | 65% |
1.下列各组金属中,活动性由弱到强的是( )
| A. | Cu、Fe、Zn | B. | Al、Mg、Zn | C. | Zn、Fe、Hg | D. | Mg、Zn、Al |


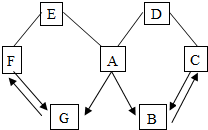 如图所示A~G是初中化学常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A是人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物.请回答:
如图所示A~G是初中化学常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A是人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物.请回答: