题目内容
13.为了对KCl 样品(含少量KNO3 )进行 分析,甲、乙、丙三位同学分别进行实验,他们实验数据如下表,请仔细观察和分析数据回答问题:(KCl+AgNO3═AgCl↓+KNO3)| 甲 | 乙 | 丙 | |
| 所取固体样品的质量/g | 20 | 10 | 10 |
| 加入AgNO3溶液的质量/g | 100 | 100 | 150 |
| 反应后所得沉淀的质量/g | 14.35 | 14.35 | 14.35 |
(2)样品中KCl 的质量分数是多少?
(3)当KCl 和AgNO3 恰好完全反应后,将沉淀过滤,此时所得溶液中溶质的质量分数是多少?(结果保留到0.1%)
分析 氯化钾和硝酸银反应生成氯化银沉淀和硝酸钾,根据氯化银的质量可以计算氯化钾的质量和生成的硝酸钾的质量,进一步可以计算样品中氯化钾的质量分数所得溶液中溶质的质量分数.
解答 解:(1)由甲和乙反应的数据可知,甲中氯化钾过量,由乙和丙反应的数据可知,丙中硝酸银过量,因此乙中的氯化钾和硝酸银恰好完全反应.
故填:乙.
(2)设氯化钾的质量为x,生成硝酸钾的质量为y,
KCl+AgNO3═AgCl↓+KNO3,
74.5 143.5 101
x 14.35g y
$\frac{74.5}{x}$=$\frac{143.5}{14.35g}$=$\frac{101}{y}$,
x=7.45g,y=10.1g,
样品中KCl的质量分数是:$\frac{7.45g}{10g}$×100%=74.5%,
答:样品中KCl的质量分数是74.5%.
(3)此时所得溶液中溶质的质量分数是:$\frac{10g-7.45g+10.1g}{10g+100g-14.35g}$×100%=13.2%,
答:此时所得溶液中溶质的质量分数是13.2%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,同时考查了分析表中数据的能力,计算时要注意规范性和准确性.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
1.下列含氯元素的物质中,氯元素的化合价由低到高的一组是( )
| A. | Cl2、CaCl2、NaClO | B. | CaCl2、NaClO、Cl2 | C. | NaClO、Cl2、CaCl2 | D. | CaCl2、Cl2、NaClO |
4.如图为甲、乙两固体的溶解度曲线,下列说法不正确的是( )
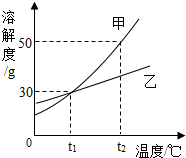

| A. | tl℃时,100g甲溶液中含甲物质的质量小于30g | |
| B. | tl℃时,甲和乙的溶解度相同 | |
| C. | t2℃时,等质量的甲、乙的饱和溶液降温到tl℃时析出晶体甲大于乙 | |
| D. | t2℃时,甲的饱和溶液溶质质量分数为50% |
18.下列各种物质中在自然界天然存在的是( )
| A. | 光导纤维和玻璃 | B. | 水泥和石灰 | C. | 塑料和橡胶 | D. | 石油和煤炭 |
5.在木炭还原氧化铜的实验中(如图),下列有关说法错误的是( )


| A. | 酒精灯加灯罩是为了集中火力,提高温度 | |
| B. | 实验结束时先撤酒精灯,再撤导管 | |
| C. | 实验中澄清的石灰水变浑浊 | |
| D. | 此实验说明木炭具有氧化性 |
