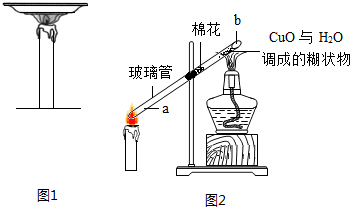
题目内容
10.草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解生成固体FeO和气体产物.某化学兴趣小组设计实验验证草酸亚铁晶体受热分解的气体产物,探究过程如下:【查阅文献】无水硫酸铜遇水变蓝
【实验设计】

(1)草酸是制取草酸亚铁的原料,请结合学过的盐酸、硫酸写出草酸的一条化学性质:能与碱发生中和反应.
(2)该兴趣小组进行上述实验时,从实验安全的角度考虑,A和E处的酒精灯应该先点燃A(填“A”或“E”).
(3)D装置的作用是干燥气体;若通过F装置中澄清石灰水变浑浊来证明草酸亚铁晶体受热分解的气体产物中有CO,则需在C和D装置之间增加盛有澄清石灰水的洗气瓶H.现象为黑色的氧化铜逐渐变成红色,F装置中澄清石灰水变浑浊时可证明产物中有CO.
(4)若B中无水硫酸铜变蓝,C中装置质量增大,E中黑色粉末变红,F中澄清石灰水变浑浊.则装置F中发生反应的化学方程式:CO2+Ca(OH)2═CaCO3↓+H2O.根据现象写出草酸亚铁晶体受热分解的化学方程式:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O↑
【反思与评价】从环保角度考虑,该套实验装置的明显缺陷是没有尾气处理装置,这时因为CO有毒,排放到空气中会造成空气污染.
分析 【实验设计】
(1)根据酸能与碱发生中和反应分析回答;
(2)根据一氧化碳与空气的混合气体点燃时易发生爆炸分析回答;
(3)根据浓硫酸具有吸水性、一氧化碳与氧化铜的反应、二氧化碳与氢氧化钙的反应分析回答;
(4)根据题干中的反应,写出反应的化学方程式;
【反思与评价】一氧化碳有毒,能污染空气.
解答 解:【实验设计】
(1)草酸是一种酸,能与碱发生中和反应.
(2)由于一氧化碳与空气的混合气体点燃时易发生爆炸,该兴趣小组进行上述实验时,从实验安全的角度考虑,该先点燃A处的酒精灯,产生的一氧化碳将玻璃管内的空气排干净后再点燃B处的酒精灯;
(3)浓硫酸具有吸水性,D装置的作用是干燥气体;若通过F装置中澄清石灰水变浑浊来证明草酸亚铁晶体受热分解的气体产物中有CO,则需在C和D装置之间增加盛有澄清石灰水的洗气瓶H.现象为黑色的氧化铜逐渐变成红色,F装置中澄清石灰水变浑浊时可证明产物中有CO.
(4)若B中无水硫酸铜变蓝说明了有水生成;C中装置质量增大,说明有二氧化碳生成;E中黑色粉末变红,F中澄清石灰水变浑浊,说明了由二氧化碳生成.则装置F中发生反应的化学方程式:CO2+Ca(OH)2═CaCO3↓+H2O.草酸亚铁晶体受热分解的化学方程式:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O↑;
【反思与评价】从环保角度考虑,该套实验装置的明显缺陷是没有尾气处理装置,这时因为CO 有毒,排放到空气中会造成空气污染.
故答为:【实验设计】
(1)草酸能与碱发生中和反应;(2)A;(3)干燥气体;黑色的氧化铜逐渐变成红色,F装置中澄清石灰水变浑浊;(4)CO2+Ca(OH)2═CaCO3↓+H2O,FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O↑;
【反思与评价】有毒.
点评 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | 酒精燃烧 | B. | 食物腐烂 | C. | 冰川融化 | D. | 牛奶变酸 |
| 反应前物质的质量/g | 反应后物质的质量/g | |
| Cu-Zn合金 | 稀硫酸 | 滤液 |
| 4.0 | 10 | 11.26 |
(2)该合金中除Cu、Zn以外的其他成分不与稀硫酸反应,请计算原Cu-Zn合金中Zn的质量分数.写出必要的计算过程.
 为了探究盐酸除铁锈的实验中,气体是由什么产生的,设计如下实验:(1)在两支试管分别放入铁粉和铁锈;(2)分别加入等量等浓度的稀盐酸,观察现象.针对该实验的目的,下列评价或改进正确的是( )
为了探究盐酸除铁锈的实验中,气体是由什么产生的,设计如下实验:(1)在两支试管分别放入铁粉和铁锈;(2)分别加入等量等浓度的稀盐酸,观察现象.针对该实验的目的,下列评价或改进正确的是( )| A. | 该实验步骤正确完整 | |
| B. | 应补充一个铁与水反应的实验 | |
| C. | 应补充一个铁锈与水反应的实验 | |
| D. | 应补充一个铁锈与水反应的实验和补充一个铁与水反应的实验 |
【查阅资料】
天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢(主要成分为碳酸盐和碱).有关物质的溶解性见下表(20℃):
| 阴离子 阳离子 | OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
【提出问题】水垢的主要成分中是否含有Ca(OH)2和MgCO3呢?
【实验方案1】确定水垢中是否含Ca(OH)2
| 实验步骤 | 实验现象 | 结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液. | 无白色沉淀 | 水垢中无Ca(OH)2 |
利用下列实验装置,完成实验2探究.其主要实验步骤如下:
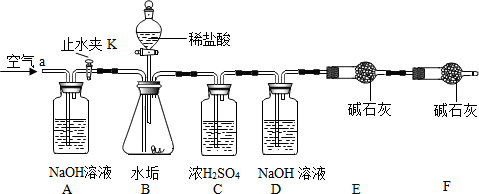
按如图组装后,将9.8g水垢试样放入锥形瓶中,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后精确称量D、E装置总质量为600.0g关闭止水夹K,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处再次缓缓鼓入空气,一段时间后称量装置D、E的总质量为604.4g(注意:碱石灰主要成分为CaO和NaOH的混合物).
【实验讨论】
(1)加入药品前应;待锥形瓶中不再产生气泡时,打开止水夹K,缓缓鼓入空气的目的是.
(2)C装置的作用是:干燥生成的气体.
(3)装置 B中生成CO2的质量为4.4g.通过计算说明该水垢中(填序号)含MgCO3.
A.一定B.一定不C.可能D.无法确定
【实验方案3】定量探究水垢中氢氧化镁的质量分数
另取质量为9.8g的水垢试样,加入7.3%稀盐酸与之恰好完全反应,测得消耗稀盐酸110g.结合以上数据和实验结论,计算水垢样品中氢氧化镁的质量分数(写出计算过程,结果保留1位小数).
【反思】缺少F装置会使所测水垢样品中氢氧化镁的质量分数偏小(填写“偏大”或“偏小”或“不变”).