题目内容
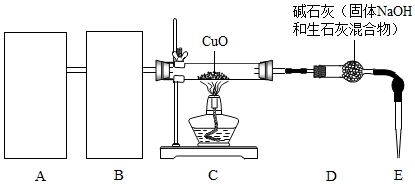
15. 某实验小组利用如图所示装置探究燃烧条件和研究CO2性质.
某实验小组利用如图所示装置探究燃烧条件和研究CO2性质.(1)探究燃烧的条件:进行此实验时,B中液体是热水,底部靠近导管口固定一小块白磷.A中固体为二氧化锰,将分液漏斗中的液体滴入A中,打开K1,看到有气泡冒出,A中发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;观察到水下的白磷燃烧时,说明可燃物燃烧需要氧气.
(2)研究CO2性质:A中充满CO2,B中紫色石蕊溶液,打开K,将分液漏斗中适量的水滴入A中,关闭K,充分反应后打开K1,看到的现象是烧杯B中的石蕊溶液进入集气瓶,且石蕊溶液变红色,A中发生反应的化学方程式CO2+H2O═H2CO3.
分析 (1)根据A中过氧化氢在二氧化锰的催化作用下生成水和氧气,结合燃烧需要同时满足三个条件:①可燃物、②氧气或空气、③温度要达到着火点,进行分析解答.
(2)A中充满CO2,打开K,将分液漏斗中适量的水滴入A中,二氧化碳能与水反应生成碳酸,进行分析解答.
解答 解:(1)A中过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
将分液漏斗中的液体滴入A中,打开K1,看到有气泡冒出,水中的白磷温度达到了着火点,且能与氧气接触,观察到水下的白磷燃烧,说明可燃物燃烧需要氧气.
(2)A中充满CO2,打开K,将分液漏斗中适量的水滴入A中,二氧化碳能与水反应生成碳酸,使装置内气体体积减少,压强减小,则看到的现象是烧杯B中的石蕊溶液进入集气瓶,且石蕊溶液变红色.
A中发生反应的化学方程式为:CO2+H2O═H2CO3.
故答案为:(1)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;水下的白磷燃烧;氧气;
(2)烧杯B中的石蕊溶液进入集气瓶,且石蕊溶液变红色;CO2+H2O═H2CO3.
点评 本题难度不大,掌握燃烧的条件、二氧化碳的化学性质、化学方程式的书写方法并能灵活运用是正确解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了以下探究.
【猜想】Ⅰ.CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.CuO是催化剂,反应前后质量和化学性质不变.
【实验】用天平称量0.2gCuO,取5mL5%过氧化氢溶液于试管中,进行如图实验:
(1)填表:
(2)步骤①的目的是对比实验,比较过氧化氢在有无氧化铜的情况下的分解速率;
步骤⑦的目的是验证氧化铜反应前后额化学性质是否改变;
为了确保实验的严谨与可靠性,步骤⑦中应选用5mL5%的过氧化氢溶液.
(3)步骤④需用到的玻璃仪器有:漏斗、烧杯、玻璃棒.
(4)写出氧化铜加入过氧化氢溶液中所发生的反应的化学方程式2H2O2$\frac{\underline{\;CuO\;}}{\;}$2H2O+O2↑.
【猜想】Ⅰ.CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.CuO是催化剂,反应前后质量和化学性质不变.
【实验】用天平称量0.2gCuO,取5mL5%过氧化氢溶液于试管中,进行如图实验:

(1)填表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 无明显现象. | 0.2g | 无明显现象 | 猜想Ⅰ成立 |
| 产生大量气泡,带火星木条复燃. | 不等于0.2g | 产生大量气泡,带火星木条复燃 | 猜想Ⅱ成立 |
| 产生大量气泡,带火星木条复燃 | 0.2g | 产生大量气泡,带火星木条复燃 | 猜想Ⅲ成立 |
步骤⑦的目的是验证氧化铜反应前后额化学性质是否改变;
为了确保实验的严谨与可靠性,步骤⑦中应选用5mL5%的过氧化氢溶液.
(3)步骤④需用到的玻璃仪器有:漏斗、烧杯、玻璃棒.
(4)写出氧化铜加入过氧化氢溶液中所发生的反应的化学方程式2H2O2$\frac{\underline{\;CuO\;}}{\;}$2H2O+O2↑.
5. 如图所示,关于电解水实验叙述错误的是( )
如图所示,关于电解水实验叙述错误的是( )
 如图所示,关于电解水实验叙述错误的是( )
如图所示,关于电解水实验叙述错误的是( )| A. | 管a中的气体是氢气 | |
| B. | 管b中的气体能使燃着的木条燃烧得更旺 | |
| C. | 电解水的实验证明水是由氢氧两种元素组成的 | |
| D. | 电解水生成的氢气与氧气的质量比是 2:1 |

 (1)如图是电解水的装置,通电一段时间后,B试管中收集到的气体是氧气,A试管和B试管中收集到的气体的体积比约等于2:1;此实验说明水是由氢、氧两种元素组成;
(1)如图是电解水的装置,通电一段时间后,B试管中收集到的气体是氧气,A试管和B试管中收集到的气体的体积比约等于2:1;此实验说明水是由氢、氧两种元素组成;