题目内容
14.初中化学课学完以后,化学兴趣小组对“金属活动性顺”从内容、规律以及应用等方面进行了总结.请你认真填写下面的空白内容:(1)金属活动性顺序表:K Ca NaMgAl Zn Fe Sn Pb (H) CuHg Ag Pt Au
(2)金属与酸反应的规律是在金属活动性顺序里,只有排在氢前面的金属才能置换出酸中的氢.试举出实际应用的实例(可用方程式表示)Fe+2HCl=FeCl2+H2↑.
(3)金属与盐发生置换反应,必须符合三点:①K、Ca、Na三种金属非常活泼,不能把金属直接从其盐溶液中置换出来;②活动性强的金属能将活动性弱的金属从它们的盐溶液中置换出来;③盐必须可溶;试举出实际应用的实例(可用化学方程式表示)Cu+2AgNO3=Cu(NO3)2+2Ag.
分析 (1)根据金属活动性顺序解答;
(2)根据金属与酸反应的条件考虑并举例写出反应的方程式;
(3)根据金属与盐发生置换反应的规律,填出金属与盐发生置换反应所需要满足的条件.
解答 解:(1)金属活动性顺序是:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au;
(2)金属与酸反应条件:在金属活动性顺序里,只有排在氢前面的金属才能置换出酸中的氢,酸不能是浓硫酸、硝酸;Fe+2HCl=FeCl2+H2↑;
(3)金属与盐发生置换反应时,K、Ca、Na三种金属非常活泼,甚至能与溶液中的水发生反应,因此,不能将金属直接从其盐溶液中置换出来;再者,活动性强的金属必须与活动性弱的金属的盐溶液发生反应,才能置换出活动性弱的金属;铜和硝酸银反应产生硝酸铜和银,反应的方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag;
故答案为:(1)Mg,Hg;(2)在金属活动性顺序里,只有排在氢前面的金属才能置换出酸中的氢;Fe+2HCl=FeCl2+H2↑;(3)活动性强的金属能将活动性弱的金属从它们的盐溶液中置换出来、盐必须可溶;Cu+2AgNO3=Cu(NO3)2+2Ag.
点评 本题主要考查金属活动性顺序的记忆与使用时需要注意的问题,金属活动顺序表有两个重要的应用,①氢后的金属不会与稀硫酸或稀盐酸反应,但氢前的金属可以与稀硫酸或稀盐酸反应;②前边的金属可以把后边的金属从其盐溶液中置换出来.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
5.下列关于氧气的说法中不正确的是( )
| A. | 氧气在低温、高压的条件下可以转变为液体或固体 | |
| B. | 植物光合作用是氧气的重要来源 | |
| C. | 氧气的化学性质比较活泼,是可燃物 | |
| D. | 因为氧气与氮气的密度不同,所以工业上分离液态空气法制取氧气 |
2.“绿色化学”是21世纪化学发展的主导方面.“绿色化学”要求从根本上消除污染,包括“绿色生产”和“绿色销毁”等内容.以下做法属于“绿色化学”的是( )
| A. | 将垃圾废物浇上汽油焚烧 | |
| B. | 加热高锰酸钾制氧气 | |
| C. | 让工业废水直接排入江河中 | |
| D. | 利用太阳能使水分解制得氢气和氧气 |
4.花匠用熟石灰来改良校园苗圃中土壤的酸性,但效果不明显,原因是熟石灰已经部分变质.于是化学老师取回该熟石灰样品,要求同学们设计实验证明该样品确实部分变质.并完成实验报告.
【实验目的】证明熟石灰样品已经部分变质
【实验仪器】试管、胶头滴管、药匙
【实验药品】熟石灰样品、蒸馏水、稀盐酸、酚酞试液
【实验目的】证明熟石灰样品已经部分变质
【实验仪器】试管、胶头滴管、药匙
【实验药品】熟石灰样品、蒸馏水、稀盐酸、酚酞试液
| 实 验 步 骤 | 实 验 现 象 | 实 验 结 论 |
| ①取少量样品放入试管中,加入适量蒸馏水,振荡,滴入酚酞试液 | 溶液呈红色 | 样品中含有氢氧化钙 |
| ②在上述试管中(或另取少量样品放入试管),加入足量的稀盐酸 | 有气泡产生 | 样品中含有碳酸钙 |
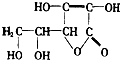 黄瓜中富含维生素C,其分子结构如图.维生素C由三种元素组成.多服用富含维生素C的事物能增强皮肤的弹性,保护大脑,并且有助于人体创伤的愈合,维生素C在pH<5的环境中较稳定,为减少维生素C的损失,黄瓜在烹饪时应加入少量的酸性物质.(填“酸性”、“碱性”或“中性”)
黄瓜中富含维生素C,其分子结构如图.维生素C由三种元素组成.多服用富含维生素C的事物能增强皮肤的弹性,保护大脑,并且有助于人体创伤的愈合,维生素C在pH<5的环境中较稳定,为减少维生素C的损失,黄瓜在烹饪时应加入少量的酸性物质.(填“酸性”、“碱性”或“中性”) 某同学模仿物理课上学到的“串联电路”,设计了如下气体制取与性质验证的组合实验.打开分液漏斗活塞后,A中出现大量气泡,B中白磷燃烧,C中液面下降,稀盐酸逐渐进入D中.请看图回答问题:
某同学模仿物理课上学到的“串联电路”,设计了如下气体制取与性质验证的组合实验.打开分液漏斗活塞后,A中出现大量气泡,B中白磷燃烧,C中液面下降,稀盐酸逐渐进入D中.请看图回答问题: