题目内容
2.镁铝合金强度大、密度小,合金表面易上色,常用作笔记本电脑的外壳.Ⅰ.(1)形状大小相同的铝和镁,分别放入同样的盐酸溶液中,下列说法不正确的是C(填序号).
A.两者都发生反应 B.镁比铝反应剧烈 C.铝不与盐酸溶液反应
(2)镁与氢氧化钠溶液不反应,而金属铝能与氢氧化钠、水共同作用生成易溶于水的钠盐(用化学式NaAlO2表示)和H2,写出该反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
Ⅱ.三位同学通过进行如下途径探究,来推算某铝镁合金(假设不含其它杂质)中铝的质量分数.
方案一:镁铝合金与氧气反应,测定参与反应的氧气体积.如图1所示,称量一定量镁铝合金 粉末,在足量的氧气中充分燃烧,冷却至室温,打开止水夹.
参与反应的氧气体积与量筒内水减少的体积相等.
方案二:铝镁合金与盐酸反应,测定生成气体的体积.装置如图2所示.
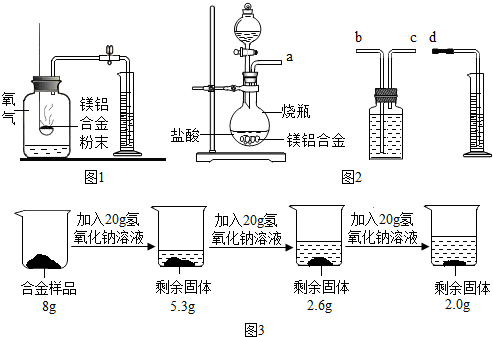
(1)通过排水法测定所收集到的氢气体积,装置导管a、b、c、d的连接顺序是:a→c→b→d.
(2)反应结束,冷却至室温.烧瓶内还留有气体,对实验结果没有(填“有”或“没有”)影响.
方案三:铝镁合金与氢氧化钠溶液反应,测定剩余固体质量.称取8g镁铝合金样品,把60g氢氧化钠溶液平均分成三份依次加入样品中,反应过程如图3:
(1)实验中所加的氢氧化钠溶液应过量,其目的是使镁铝合金中的铝完全反应.
(2)从上图数据可知,该合金中镁元素与铝元素的质量比为1:3.
【反思与拓展】利用铝镁合金中铝与氢氧化钠溶液反应反应和方案二装置,通过测定氢气体积,也可得出合金中铝的质量.
分析 Ⅰ.(1)根据镁和铝都和盐酸反应但金属镁比铝活泼进行解答;
(2)根据铝和氢氧化钠溶液反应生成偏铝酸钠和氢气进行解答;
Ⅱ方案一:根据氧气被消耗掉后瓶内压强减小,所以进入水的体积等于氧气进行解答;
方案二:(1)根据氢气不溶于水,用排水法收集,所以应该是从短管进长管出,排出水的体积就是氢气体积进行解答;
(2)反应结束,冷却至室温.烧瓶内还留有气体,对实验结果没有影响;
方案三:(1)实验中所加的氢氧化钠溶液应过量,其目的是使镁铝合金中的铝完全反应;
(2)根据剩余固体的质量为金属镁的质量进行解答;
【反思与拓展】利用铝镁合金中铝与氢氧化钠溶液反应反应和方案二装置,通过测定氢气体积,也可得出合金中铝的质量.
解答 解:Ⅰ.(1)镁和铝都和盐酸反应但金属镁比铝活泼,所以镁比铝反应剧烈,故选C;
(2)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,该反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
Ⅱ方案一:氧气被消耗掉后瓶内压强减小,所以进入水的体积等于氧气;
方案二:(1)氢气不溶于水,用排水法收集,所以应该是从短管进长管出,排出水的体积就是氢气体积,所以装置导管口a、b、c、d的连接顺序是:a→c→b→d;
(2)反应结束,冷却至室温.烧瓶内还留有气体,对实验结果没有影响;
方案三:(1)实验中所加的氢氧化钠溶液应过量,其目的是使镁铝合金中的铝完全反应;
(2)剩余固体的质量为金属镁的质量,所以镁的质量为2g,铝的质量为8g-2g=6g,所以该合金中镁元素与铝元素的质量比为2g:6g=1:3;
【反思与拓展】利用铝镁合金中铝与氢氧化钠溶液反应反应和方案二装置,通过测定氢气体积,也可得出合金中铝的质量.
故答案为:Ⅰ.(1)C;
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
Ⅱ.方案一 量筒内水减少的体积;
方案二(1)c→b→d;
(2)没有;
方案三(1)使镁铝合金中的铝完全反应; (2)1:3;
【反思与拓展】氢气.
点评 本题属于信息题的考查,解答本题要掌握合金的含义及其各种合金的组成方面的知识,只有这样才能对相关方面的问题做出正确的判断.

| A. | 把食品放入冰箱中低温贮藏 | |
| B. | 调节燃气灶的进风口使天然气燃烧更充分 | |
| C. | 在铁制品表面刷上防锈漆 | |
| D. | 往保存粮食的仓库中通入适量氮气 |
| A. | 用氖气作焊接金属的保护气 | |
| B. | 加入净水剂(如明矾),使硬水转化成纯净水 | |
| C. | 寻找新的催化剂使水变成油 | |
| D. | 改变物质的性质一定要通过化学变化 |
| A. | 原子在化学变化中可以再分 | B. | 分子间没有间隔 | ||
| C. | 分子在不断地运动 | D. | 原子不能直接构成物质 |
| A. | 将气体分别通入水中 | B. | 气体分别通入澄清的石灰水中 | ||
| C. | 将气体分别通入紫色石蕊试液中 | D. | 带火星的木条分别伸入两瓶气体中 |
 如图所示,其中①、②、③、④、⑤、⑥分别是铁、氯化钙溶液、硝酸银溶液、稀盐酸、氢氧化钙溶液、碳酸钠溶液中的一种.图中相连的两圆表示相应物质能发生反应,已知②和①、②和⑤反应都有气泡出现.则下列说法不正确的是( )
如图所示,其中①、②、③、④、⑤、⑥分别是铁、氯化钙溶液、硝酸银溶液、稀盐酸、氢氧化钙溶液、碳酸钠溶液中的一种.图中相连的两圆表示相应物质能发生反应,已知②和①、②和⑤反应都有气泡出现.则下列说法不正确的是( )| A. | ①与②、①与③反应都属于置换反应 | B. | ③、⑤和⑥都是盐 | ||
| C. | ③与⑥反应会生成白色沉淀 | D. | ②和③反应属于中和反应 |
