题目内容
4.(1)根据硝酸铵[NH4NO3]的化学式计算:硝酸铵中氮、氢、氧元素的质量比为7:1:12;硝酸铵中氮元素的质量分数为35%.(2)电解水时,常常加入NaOH以增强水的导电性.450g 10%的NaOH溶液通电一段时间后,NaOH的质量分数变为12.5%.求:①溶液中NaOH的质量.②电解后,剩余氢氧化钠溶液的质量是多少.③电解产生的氧气质量是多少.
分析 (1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析解答.
(2)根据电解水前后,溶质的质量不变,结合题意进行分析解答.
解答 解:(1)硝酸铵中氮、氢、氧三种元素的质量之比是(14×2):(1×4):(16×3)=7:1:12.硝酸铵中氮元素的质量分数为$\frac{14×2}{14×2+1×4+16×3}$×100%=35%.
(2)①溶液中NaOH的质量为450g×10%=45g
②设电解后,剩余氢氧化钠溶液的质量是x,根据电解水前后,溶质的质量不变,
则450g×10%=x×12.5% x=360g
③电解水的质量为450g-360g=90g
设电解产生的氧气质量是y
2H2O $\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑
36 32
90g y
$\frac{36}{90g}$=$\frac{32}{y}$
y=80g
故答案为:(1)7:1:12;35%(2)①45g
②360g
③80g.
点评 本题主要考查学生灵活运用化学式的有关计算、化学方程式和质量分数公式进行计算的能力.学生需认真分析数量关系,才能正确解答.

练习册系列答案
相关题目
14.保护资源、合理利用资源是每个公民的责任,下列做法不利于保护金属资源的是( )
| A. | 铸铁暖气片金属表面刷银粉形成保护层 | |
| B. | 国家加大开采矿物的力度,并鼓励私人到处开采 | |
| C. | 及时除去钢铁制品表面的铁锈 | |
| D. | 回收废旧的易拉罐 |
9.能证明木炭、金刚石、石墨都含有碳元素的方法是( )
| A. | 分别置于氧气中燃烧,都能得到一种产物CO2 | |
| B. | 观察它们的颜色来判断 | |
| C. | 测定三种物质的密度来判断 | |
| D. | 测定它们的硬度来判断 |
13.根据图某反应微观示意图判断下列说法正确的是( )
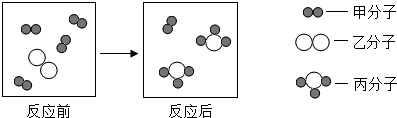

| A. | 参加反应的甲和乙分子个数比为4:1 | |
| B. | 该反应属于置换反应 | |
| C. | 反应前后原子的种类、数目都不变 | |
| D. | 反应前后各种元素的化合价都不变 |
14.化学在生活中用途广泛.下列有关说法正确的是( )
| A. | 可用点燃的方法检验天然气是否泄漏 | |
| B. | 回收废弃的塑料可以减少“白色污染” | |
| C. | 食用甲醛水溶液浸泡过的海产品对人体无害 | |
| D. | 在香肠中添加过量的亚硝酸钠保持肉质鲜美 |
