题目内容
6.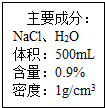 如图是一瓶医用注射盐水标签的部分内容.
如图是一瓶医用注射盐水标签的部分内容.(1)氯化钠中钠元素和氯元素的质量比是46:71;
(2)该瓶盐水能给病人提供氯化钠的质量是4.5g;
(3)该瓶盐水能给病人提供钠元素的质量是1.8g(精确到0.1g).
分析 (1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
(2)根据溶质的质量分数计算;
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析判断.
解答 解:(1)氯化钠中钠、氯元素的质量比是:23:35.5=46:71.
(2)500mL=500cm3,一瓶盐水的质量为中1g/cm3×500cm3=500g,氯化钠的质量分数为0.9%,则一瓶盐水能给病人提供氯化钠的质量是:500g×0.9%=4.5g.
C、一瓶盐水能给病人提供氯化钠的质量是500g×0.9%=4.5g,能给病人提供钠元素的质量为4.5g×$\frac{23}{58.5}$×100%≈1.8g
故答为:(1)46:71;(2)4.5;(3)1.8.
点评 本题难度不大,考查同学们结合标签新信息、灵活运用溶质质量分数的计算、化学式的有关计算、纯净物与混合物的判别方法等进行分析问题、解决问题的能力.

练习册系列答案
相关题目
16.下面表格中列出了KCl在不同温度 下的溶解度:
(1)由上表可推出KCl溶解度的变化规律是氯化钾的溶解度随着温度的升高而增大.
(2)在20℃时,向100g水中加入50g KCl,形成的是饱和(填“饱和”或“不饱和”)溶液,将其温度升高到40℃时,该溶液中溶质与溶剂的质量比为2:5.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 |
(2)在20℃时,向100g水中加入50g KCl,形成的是饱和(填“饱和”或“不饱和”)溶液,将其温度升高到40℃时,该溶液中溶质与溶剂的质量比为2:5.
17.下列有关叙述中,不正确的是( )
| A. | 铝的抗腐蚀性能比铁强,原因是铝的金属活动性比铁更不活泼 | |
| B. | 真金不怕火炼,原因是金的金属性质很不活泼 | |
| C. | 钠的化学性质非常活泼,所以自然界中没有单质形式存在的钠 | |
| D. | 光亮的铁块放入火中灼烧后会变黑,原因是表面附上了一层黑色的四氧化三铁 |
11.某农民种植的荔枝因缺磷肥和氮肥而出现生长较慢,叶色泛黄,且产量低的现象.下列肥料最适合它使用的是( )
| A. | CO(NH2)2 | B. | KCl | C. | Ca(H2PO4)2 | D. | NH4H2PO4 |
18.X、Y、Z、Q是常见的四种元素,X的原子核内只有一个质子,Y的单质在空气中含量最多,Z的原子序数为11,Q与X形成的化合物的水溶液常用来除铁锈.下列有关说法不正确的是( )
| A. | Q原子的结构示意图为 | B. | Z、Q组成的化合物由离子构成 | ||
| C. | X、Y组成的化合物可表示为X3Y | D. | X、Y、Q组成的化合物可用作氮肥 |
16.下列做法不正确的是( )
| A. | 用灼烧的方法区别棉花和羊毛 | |
| B. | 用水鉴别NH4NO3、NaOH、NaCl三种固体 | |
| C. | 将草木灰(含K2CO3)与氯化铵混合施用,增进肥效 | |
| D. | 按溶解、过滤、蒸发的主要操作顺序分离CaCl2、CaCO3的固体混合物 |

 ,当a=8时.该粒子是阴离子(填“原子”、“阳离子”或“阴离子”);
,当a=8时.该粒子是阴离子(填“原子”、“阳离子”或“阴离子”);