题目内容
9.海水、湖水都是重要的工业原料.(1)海水中含有MgCl2和NaCl等多种物质,利用海水提取金属镁的工业流程如图1所示:
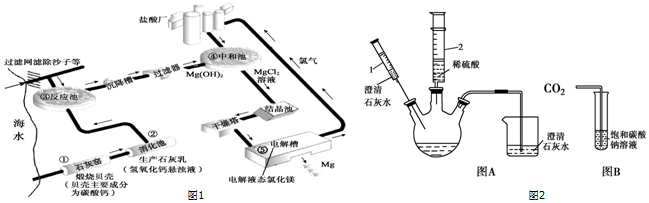
I.在①~⑤的每个反应装置内都发生了化学反应,发生分解反应的装置有①⑤(填序号).
II.写出装置③内发生反应的化学方程式MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
(2)盐湖中还含有大量的碳酸钠,课外小组同学利用图2中图A、图B所示装置验证碳酸钠的性质.
①利用图A装置进行如下实验
步骤一:向三口瓶内的碳酸钠溶液中滴加酚酞,溶液显红色.
步骤二:将注射器1的针头向瓶内推进,使针头下端进入瓶内液面下,向外拉注射器,此时注射器1中反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,看到明显现象后,将针头向上拉至图示所示位置.
步骤三:将注射器2的足量稀盐酸全部推进瓶内,能观察到的实验现象有溶液由红色变成无色,产生气泡
步骤四:在碳酸钠被足量盐酸反应完后再将之前注射器1中的物质全部推入瓶内充分反应后得到无色透明澄清液体,则此溶液中一定含有的溶质(除酚酞外)为氯化钠、氯化钙
②利用图B装置进行实验.请阅读下表写出将二氧化碳持续通入饱和碳酸钠溶液中生成碳酸氢钠的化合反应的方程式Na2CO3+H2O+CO2=2NaHCO3.
| 物质 | 20℃时溶解度/g | 相对分子质量 |
| Na2CO3 | 21.5 | 106 |
| NaHCO3 | 9.6 | 84 |
分析 (1)①中碳酸钙在高温条件下分解生成氧化钙和二氧化碳,②中氧化钙和水反应生成氢氧化钙,③中氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,④中氢氧化镁和稀盐酸反应生成氯化镁和水,⑤中电解氯化镁生成镁和氯气;
(2)碳酸钠溶液显碱性,能使酚酞试液变红色;
碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,和稀盐酸反应生成氯化钠、水和二氧化碳;
碳酸钠和水、二氧化碳反应生成碳酸氢钠.
解答 解:(1)①中碳酸钙在高温条件下分解生成氧化钙和二氧化碳,属于分解反应,②中氧化钙和水反应生成氢氧化钙,属于化合反应,③中氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,属于复分解反应,④中氢氧化镁和稀盐酸反应生成氯化镁和水,属于复分解反应,⑤中电解氯化镁生成镁和氯气,属于分解反应,因此在①~⑤中发生分解反应的装置有①⑤;
I装置③内,氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,发生反应的化学方程式为:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
故填:①⑤;MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
(2)①步骤二:将注射器1的针头向瓶内推进,使针头下端进入瓶内液面下,向外拉注射器,此时注射器1中,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
步骤三:将注射器2的足量稀盐酸全部推进瓶内,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,溶液由碱性变成中性,能观察到溶液由红色变成无色,产生气泡.
故填:溶液由红色变成无色,产生气泡.
步骤四:则此溶液中一定含有的溶质(除酚酞外)为反应生成的氯化钠和氯化钙.
故填:氯化钠、氯化钙.
②将二氧化碳持续通入饱和碳酸钠溶液中时,碳酸钠和水、二氧化碳反应生成碳酸氢钠,反应的化学方程式为:Na2CO3+H2O+CO2=2NaHCO3.
故填:Na2CO3+H2O+CO2=2NaHCO3.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

| A. | Na2SO4、Ba(OH)2、H2SO4 | B. | Na2CO3、AgNO3、HCl | ||
| C. | AgNO3、CaCl2、HNO3 | D. | NaOH、MgCl2、H2SO4 |
①蒸发掉20克水 ②蒸发后溶液中还剩20克水 ③加入3.2克食盐 ④加入5克食盐.
| A. | ①④ | B. | ①② | C. | ②④ | D. | ①②④ |
| 加入稀盐酸的次序 | 1 | 2 | 3 | 4 |
| 加入稀盐酸的质量(克) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(克) | 4.0 | m | 1.2 | 1.2 |
(2)m=2.0.
(3)样品中碳酸钙的质量分数是多少?
(4)所用稀盐酸的质量分数是多少?
| A. | 滴入浓硫酸 | B. | 看颜色是否鲜艳 | C. | 灼烧后闻气味 | D. | 无法鉴别 |
 如图,在盛有一定质量分数稀硫酸的容器中,放一塑料方块.刚好能悬浮于稀硫酸中,若向容器中加入少量氯化钡溶液后,则塑料方块在溶液中( )
如图,在盛有一定质量分数稀硫酸的容器中,放一塑料方块.刚好能悬浮于稀硫酸中,若向容器中加入少量氯化钡溶液后,则塑料方块在溶液中( )| A. | 下沉 | B. | 上浮 | C. | 不变 | D. | 无法判断 |

