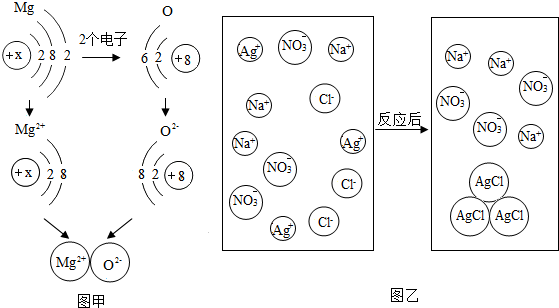
题目内容
2.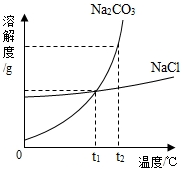 (1)我国化学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,制得纯碱(Na2CO3),Na2CO3和NaCl的溶解度曲线如图所示:
(1)我国化学家侯德榜创立的侯氏制碱法,就是以海水“晒盐”得到的氯化钠为原料,制得纯碱(Na2CO3),Na2CO3和NaCl的溶解度曲线如图所示:回答下列问题:
①t1℃时,Na2CO3的溶解度等于NaCl的溶解度(填“大于”“等于”“小于”之一).
②若Na2CO3中混有少量的NaCl固体,可用降温结晶方法提纯Na2CO3.
③t1℃时,将15gNa2CO3固体加入到50g水中,所得溶液的溶质质量分数为23.1%(精确至0.1%)
(2)工业上通过如下转化可制得KClO3晶体;

①完成Ⅰ反应的化学方程式:NaCl+3H2O$\frac{\underline{\;通电\;}}{△}$NaClO3+3H2↑
②Ⅱ中析出晶体后的母液是KClO3的饱和(填“饱和”“不饱和”之一)溶液.
分析 (1)①根据碳酸钠和氯化钠的溶解度曲线比较;
②根据碳酸钠和氯化钠的溶解度随温度变化的情况分析;
③根据溶质质量分数公式进行解答;
(2)①根据氯化钠和水反应生成氯酸钠和氢气进行解答;
②根据有氯酸钾晶体析出进行解答.
解答 解:(1)①由碳酸钠和氯化钠的溶解度曲线可知,在t1℃时,氯化钠的溶解度等于碳酸钠的溶解度;故填:等于;
②由碳酸钠和氯化钠的溶解度曲线可知,碳酸钠的溶解度受温度的影响较大,氯化钠的溶解度受温度的影响不大若Na2CO3中混有少量的NaCl固体,可用降温结晶方法提纯Na2CO3;故填:降温结晶;
③t1℃时,将15gNa2CO3固体加入到50g水中,所得溶液的溶质质量分数=$\frac{15g}{15g+50g}×100%$=23.1%;故填:23.1%;
(2)①氯化钠和水反应生成氯酸钠和氢气,反应Ⅰ反应方程式为NaCl+3H2O$\frac{\underline{\;通电\;}}{△}$NaClO3+3H2↑;故答案为:NaCl+3H2O$\frac{\underline{\;通电\;}}{△}$NaClO3+3H2↑;
②有氯酸钾晶体析出,所以②Ⅱ中析出晶体后的母液是KClO3的饱和溶液.故填:饱和.
点评 本题考查了学生根据所给的问题情景、图表信息,结合所学溶解度等相关知识和技能,细心地探究、推理,按照题目要求进行认真分析解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.对图所示实验现象分析正确的是( )
| A. |  实验中试管内液面上升,说明试管内压强增大 实验中试管内液面上升,说明试管内压强增大 | |
| B. |  实验中小气球迅速胀大,说明NaOH能与CO2反应 实验中小气球迅速胀大,说明NaOH能与CO2反应 | |
| C. | 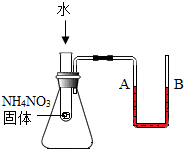 实验中U型管内液面左高右低,说明NH4NO3能与水发生反应 实验中U型管内液面左高右低,说明NH4NO3能与水发生反应 | |
| D. | 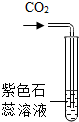 实验中紫色石蕊溶液变红,说明CO2是一种酸 实验中紫色石蕊溶液变红,说明CO2是一种酸 |
14.根据下列仪器装置,回答有关问题.
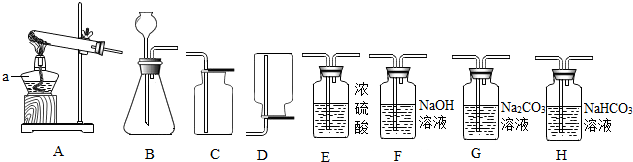
(1)制取氧气.实验室选用装置A制取氧气时,用到的化学药品是KClO3和MnO2(用化学式表示);收集氧气可以选用的装置是C填装置序号).实验结束熄灭酒精灯的操作为用灯帽盖灭(盖灭后轻提下灯帽).
(2)制取二氧化碳.用一定浓度的盐酸与石灰石反应制取二氧化碳气体,发生反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O.为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为(B)→H→(E)→干燥、纯净CO2 (在括号内填装置序号).
(3)进一步探究二氧化碳与氢氧化钠溶液的反应.
【提出问题】制取干燥、纯净的二氧化碳气体流程中,选用装置H而不用G,因为碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O═2NaHCO3.向氢氧化钠溶液中通入一定量二氧化碳后,所得溶液中溶质是什么?
【查阅资料】碳酸氢钠与氢氧化钠发生反应:NaOH+NaHCO3═Na2CO3+H2O;Ca(HCO3)2溶于水.
【猜想】所得溶液中的溶质是:
①Na2CO3;②NaHCO3;③Na2CO3和NaHCO3;④Na2CO3和NaOH.
【实验】请你参与下列验证猜想③的实验,完成探究报告.
【讨论】二氧化碳通入一定量的氢氧化钠溶液,影响反应后生成物成分的决定因素
是通入二氧化碳的量多少.

(1)制取氧气.实验室选用装置A制取氧气时,用到的化学药品是KClO3和MnO2(用化学式表示);收集氧气可以选用的装置是C填装置序号).实验结束熄灭酒精灯的操作为用灯帽盖灭(盖灭后轻提下灯帽).
(2)制取二氧化碳.用一定浓度的盐酸与石灰石反应制取二氧化碳气体,发生反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O.为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为(B)→H→(E)→干燥、纯净CO2 (在括号内填装置序号).
(3)进一步探究二氧化碳与氢氧化钠溶液的反应.
【提出问题】制取干燥、纯净的二氧化碳气体流程中,选用装置H而不用G,因为碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O═2NaHCO3.向氢氧化钠溶液中通入一定量二氧化碳后,所得溶液中溶质是什么?
【查阅资料】碳酸氢钠与氢氧化钠发生反应:NaOH+NaHCO3═Na2CO3+H2O;Ca(HCO3)2溶于水.
【猜想】所得溶液中的溶质是:
①Na2CO3;②NaHCO3;③Na2CO3和NaHCO3;④Na2CO3和NaOH.
【实验】请你参与下列验证猜想③的实验,完成探究报告.
| 步骤和方法 | 现象 | 分析 |
| 取少量反应后的溶液,加入足量的CaCl2溶液 | 产生白色沉淀 | 发生反应的方程式: CaCl2+Na2CO3=CaCO3↓+2NaCl |
| 过滤,向滤液中加入少量NaOH溶液 | 产生白色沉淀 | 结论:猜想③正确 |
是通入二氧化碳的量多少.
12.科学家屠呦呦因提取青蒿素(C15H22O5)而获得2015年诺贝尔奖,下列说法不正确的是( )
| A. | 青蒿素属于有机物 | |
| B. | 青蒿素的相对分子质量为282 | |
| C. | 一个青蒿素分子由15个碳原子、12个氢原子和5个水分子构成 | |
| D. | 青蒿素中碳、氢、氧三种元素的质量比为90:11:40 |
 .
.