题目内容
为了测定某品牌食用纯碱中碳酸钠的质量分数,小明取10克食用纯碱样品和足量的溶质质量分数为10﹪的稀硫酸,进行如图甲实验,实验前后,均需往装置中缓慢通一会儿氮气。(样品中其他成分不与稀硫酸反应)

(1)实验前,先往A装置通入一会儿氮气的目的是__________。
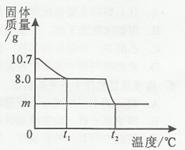
(2)随着纯碱样品与稀硫酸反应,C装置增加的质量变化情况如图乙所示,则该食用纯碱中碳酸钠的质量分数是多少? (碳酸钠与稀硫酸反应的化学方程式:Na2CO3+H2SO4= Na2SO4++H2O+CO2↑)
(3)若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,请说明理由__________。
【答案】(1)避免装置内原有的二氧化碳对实验的干扰
(2)解:由图可知生成二氧化碳的质量是3.52g。
设纯碱样品中含碳酸钠质量为x。
Na2CO3+H2SO4= Na2SO4++H2O+CO2↑
106 44
x 3.52g
106:44=x:3.52g
x=8.48g
纯碱样品中碳酸钠的质量分数为8.48g/10g×100﹪=84.8﹪
答:该食用纯碱中碳酸钠的质量分数为84.8﹪。
(3)浓盐酸具有挥发性,挥发出的气体被C装置中的氢氧化钠溶液吸收。
【解析】(1)实验前A装置中含有空气,空气中二氧化碳会对C装置质量的变化产生影响,先往A装置通入一会儿氮气的目的是避免装置内原有的二氧化碳对实验的干扰;(2)C装置增加的质量为反应产生的二氧化碳的质量,以及二氧化碳的质量和反应的化学方程式可以求出样品中碳酸钠的质量,进而可以求出样品中碳酸钠的质量分数;(3)浓盐酸有挥发性,能以被氢氧化钠溶液吸收,从而导致C装置的质量变化偏大。

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案为验证某混合气体中是否含有一氧化碳、二氧化碳 和水蒸气,同学设计了如下实验装置(装置气密性良好),将混合气体依次通入。实验现象记录如下。(药品均足量且每步反应完全、夹持仪器省略)

| 装置 | 现象 |
| 甲 | 增重 |
| 乙 | 无明显现象 |
| 丙 | 粉末由 变红 |
| 丁 | 试液由紫变红,气球变大 |
Ⅰ.仪器a的名称 (21) 。
Ⅱ.丙中粉末由 (22) 变红,发生的化学反应方程式为 (23) ,其中氧化铜作 (24)  剂。
剂。
Ⅲ.根据上述现象,分析混合气体中一定含有水蒸气、一氧化碳,可能含有二氧化碳 。写出可能 含有二氧化碳的理由 (25) 。
含有二氧化碳的理由 (25) 。
Ⅳ.在不改变装置的前提下,只需将装置 (26) 中药品换成 (27) ,即可判断二氧化碳是否存在。
某同学在实验室发现一瓶由碳酸钠和氯化钠组成的混合溶液.为了测定该混合溶液中碳酸钠的质量分数,该同学设计了如下实验:取该混合溶液50g,向其中逐滴加入稀盐酸,当加入盐酸的质量为15g、30g、45g、60g时,生成气体的质量见下表(气体的溶解度忽略不计).
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
| 稀盐酸的质量/g | 15 | 30 | 45 | 60 |
| 生成气体的质量/g | 1.8 | n | 4.4 | 4.4 |
(1)第Ⅱ组数据n为 _________ g.
(2)混合溶液中碳酸钠的质量分数是多少?(写出计算过程,结果精确至0.1%)
 ;主要含维生素的有 。
;主要含维生素的有 。
 CuSO4+ xH2O↑
CuSO4+ xH2O↑