题目内容
10.某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出m克合金样品,将60克稀硫酸分6次慢慢加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10克 | n克 |
| 第二次加入10克 | 2.0克 |
| 第三次加入10克 | 1.5克 |
| 第四次加入l0克 | 1.0克 |
| 第五次加入10克 | 0.6克 |
| 第六次加入10克 | 0.6克 |
(2)题中,m=3 n=2.5
(3)计算合金样品中镁的质量分数.
(4)计算所用稀硫酸中H2S04的质量分数.
分析 (1)镁和硫酸反应生成硫酸镁和氢气,可以据此解答该题;
(2)根据表格中的数据可分析出与10克稀硫酸恰好完全反应的镁的质量,进而可确定m的值.
(3)反应前后固体物质减少的质量为镁的质量,根据质量分数的计算公式可以求出镁铜合金中镁的质量分数.
(4)根据表格中数据利用镁与硫酸反应的化学方程式,根据镁的质量可以计算出硫酸的质量,然后根据求出反应后溶液中溶质的质量分数即可.
解答 解:(1)镁和硫酸反应生成硫酸镁和氢气,该反应的化学方程式为:Mg+H2S04═MgS04+H2↑;
(2)根据表格中的数据可分析出与10克稀硫酸恰好完全反应的镁的质量为0.5g,所以可以判断n=2.5,进而可以推断m=3;
(3)根据表格中的数据可以知道第5次和第6次剩余的质量均为0.6g,可以判断铜的质量为0.6g,所以镁的质量为:3g-0.6g=2.4g
故合金样品中镁的质量分数为:$\frac{2.4g}{3g}$×100%=80%;
(4)设10g稀硫酸中硫酸的质量为x
Mg+H2S04═MgS04+H2↑$\frac{2.45g}{10g}$
24 98
0.6g x
$\frac{24}{0.5g}$=$\frac{98}{x}$
解得:x=2.04g
所用稀硫酸中H2S04的质量分数为:$\frac{2.04g}{10g}$×100%=20.4%
答:(3)合金样品中镁的质量分数为80%;
(4)所用稀硫酸中H2S04的质量分数为=20.4%
故答案为:(1)Mg+H2S04═MgS04+H2↑;
(2)3;2.5;
(3)80%;
(4)20.4%.
点评 本考点考查了表格型计算题,属于质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律,还要记牢“遇到差值要想气体”.本考点主要出现在计算题中.

 阅读快车系列答案
阅读快车系列答案(1)碳酸氢铵的一点物理性质易溶于水;
(2)碳酸氢铵的一点化学性质受热易分解.
【提出问题】A.为什么要避免高温天气使用?B.这种化肥含氮量是否达到17.7%,化肥中碳酸氢铵的含量是多少?带着这些问题,她取了一些化肥样品,进入实验室.
【查找资料】A.碱石灰能够吸收水和二氧化碳,但是不吸收氨气. B.浓硫酸能吸收氨气.
【性质实验探究】她设计了如图2的实验装置:
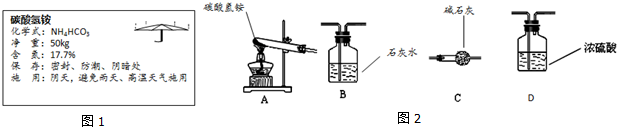
(3)用A装置给碳酸氢铵加热,装药品前,她必须进行的一步操作是检查装置的气密性.
(4)取少量碳酸氢铵加入试管,加热,闻到刺激性气味,此气体化学式为NH3.
(5)连接A、B装置,继续加热,观察到A试管口的现象是有水珠出现,B中的现象是澄清石灰水变浑浊.
(6)碳酸氢铵在受热时发生反应的表达式是NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O.
| 实验前D装置的质量 | 150g |
| 实验后D装置的质量 | 151.7g |
(7)由此分析得知:反应中产生氨气的质量为1.7g.
(8)通过反应的表达式可以知道:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥含氮量为14%.
【反思】如果将装置A、C(气体流向:从b到a)、D依次连接,会使此化肥含氮量不变(变大或变小或不变).
| A. | 空气能被压缩--分子体积可以变小 | |
| B. | 甘蔗甜,苦瓜苦--构成物质的分子不同,性质不相同 | |
| C. | 远处闻到花的香味-------分子在不断地远动 | |
| D. | 50mL水和50mL酒精混合后的总体积小于100mL--分子之间有间隔 |
| A. | CuO | B. | CO2 | C. | CuSO4溶液 | D. | H2SO4 |
| A. | CH4 | B. | CO2 | C. | O3 | D. | H2 |