题目内容
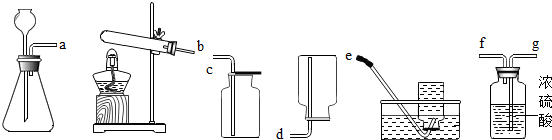
现甲、乙两化学小组安装两套如图1相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素.
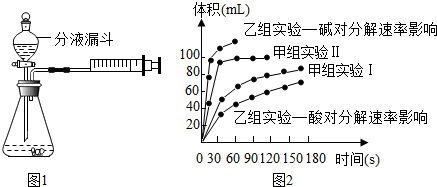
(1)下列方法能检查该装置气密性的是 .
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差.
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差.
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差.
(2)MnO2催化下H2O2分解的化学方程式是 .
(3)甲小组有如表实验设计方案,完成如表.
(4)甲、乙两小组得出如图2数据.
①甲组实验得出的数据可知:浓度越大,H2O2分解速率 ;
②由乙组研究的酸、碱对H2O2分解影响因素的 数据分析:相同条件下,H2O2在 填“酸”或“碱”)性环境下放出气体速率较快;乙组提出可以用Ba02固体与硫酸溶液反应制H202(已知还生成另一种物质),其化学反应方程式为 ;支持这一方案的理由是 .

(1)下列方法能检查该装置气密性的是
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差.
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差.
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差.
(2)MnO2催化下H2O2分解的化学方程式是
(3)甲小组有如表实验设计方案,完成如表.
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
①甲组实验得出的数据可知:浓度越大,H2O2分解速率
②由乙组研究的酸、碱对H2O2分解影响因素的 数据分析:相同条件下,H2O2在
考点:影响化学反应速率的因素探究,检查装置的气密性,催化剂的特点与催化作用,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:(1)气密性检验的原则是先让装置和水构成封闭的整体,改变某一条件使压强发生改变来判断气密性的好坏;
(2)MnO2催化下H2O2分解为氧气和水;
(3)对照实验要控制只能有一个变量,此变量为H2O2的浓度,则催化剂应保持一致;
(4)①在体积-时间图,斜率即可代表化学反应速率;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析可知碱性越强,由图可知碱性强分解速率越快,
(2)MnO2催化下H2O2分解为氧气和水;
(3)对照实验要控制只能有一个变量,此变量为H2O2的浓度,则催化剂应保持一致;
(4)①在体积-时间图,斜率即可代表化学反应速率;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析可知碱性越强,由图可知碱性强分解速率越快,
解答:解:(1)气密性的检验是根据压强原理,可以关闭分液漏斗活塞,将注射器外移看停止用力后看注射器活塞能够复原,也可固定注射器活塞,采用液面差法,也可用升高温度法,故选AB;
(2)H2O2在MnO2催化下分解生成水和氧气,化学方程式为:2H2O2
O2↑+2H2O;
(3)由甲组两个实验对比可以看出实验Ⅱ中催化剂与实验Ⅰ中的相同,而过氧化氢浓度不同,因此甲组的实验目的为探究浓度对速率的影响;
(4)①由图象可知在体积-时间图,斜率即可代表化学反应速率,由甲组实验两条曲线可知,甲组实验Ⅱ斜率大,因此H2O2的浓度越大分解速率越快,
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析可知碱性越强,放出气体的速率越快,由题意知Ba02固体与H2SO4溶液反应制H202的反应物为Ba02和H2SO4,产物为H202,根据原子守恒可知另一种产物为硫酸钡,即:Ba02+H2SO4=H202+BaSO4↓,由图可知酸性条件下,H202分解的速率慢,
故答案为:
(1)AB;(2)2H2O2
2H2O+O2↑;(3)浓度;
(4)①越快;②碱;BaO2+H2SO4=BaSO4↓+H2O2;过氧化氢在酸性环境下分解较慢.
(2)H2O2在MnO2催化下分解生成水和氧气,化学方程式为:2H2O2
| ||
(3)由甲组两个实验对比可以看出实验Ⅱ中催化剂与实验Ⅰ中的相同,而过氧化氢浓度不同,因此甲组的实验目的为探究浓度对速率的影响;
(4)①由图象可知在体积-时间图,斜率即可代表化学反应速率,由甲组实验两条曲线可知,甲组实验Ⅱ斜率大,因此H2O2的浓度越大分解速率越快,
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析可知碱性越强,放出气体的速率越快,由题意知Ba02固体与H2SO4溶液反应制H202的反应物为Ba02和H2SO4,产物为H202,根据原子守恒可知另一种产物为硫酸钡,即:Ba02+H2SO4=H202+BaSO4↓,由图可知酸性条件下,H202分解的速率慢,
故答案为:
(1)AB;(2)2H2O2
| ||
(4)①越快;②碱;BaO2+H2SO4=BaSO4↓+H2O2;过氧化氢在酸性环境下分解较慢.
点评:此题考查外界因素对化学反应速率的影响,涉及气密性的检验方法主要有三个,则答案不唯一,但原则都是先让装置和水构成封闭的整体,改变某一条件使压强发生改变来判断气密性的好坏,此题综合性较强,难度适中.

练习册系列答案
相关题目
下列物质属于酸的是( )
| A、H2CO3 |
| B、NaHCO3 |
| C、SO2 |
| D、NH3?H2O |