题目内容
4.下列各组物质在给定条件下能大量共存的是( )| A. | 在 pH=1 的溶液中:NaCl、Na2CO3、Na2SO4 | |
| B. | 在 pH=2 的溶液中:KCl、Na2SO4、HNO3 | |
| C. | 在 pH=13 的溶液中:BaCl2、Na2CO3、NaOH | |
| D. | 在 pH=14 的溶液中:FeCl3、Ba ( NO3 )2、CaCl2 |
分析 pH为1、2的水溶液显酸性,水溶液中含有大量的H+;pH为13、14的水溶液显碱性,水溶液中含有大量的OH-;根据复分解反应发生的条件可知,若物质之间相互交换成分不能生成水、气体、沉淀,则能够在溶液中大量共存,据此进行分析判断即可.
解答 解:A、pH=1的溶液显酸性,水溶液中含有大量的H+;Na2CO3与酸性溶液中的H+两种离子能结合成水和二氧化碳,不能大量共存,故选项错误.
B、pH=2的溶液显酸性,水溶液中含有大量的H+;离子间不能结合成沉淀、气体或水,能大量共存,故选项正确.
C、pH=13的溶液显酸性,水溶液中含有大量的OH-;BaCl2、Na2CO3能结合成碳酸钡白色沉淀,不能大量共存,故选项错误.
D、pH=14的溶液显碱性,水溶液中含有大量的OH-;FeCl3与碱性溶液中的OH-结合生成氢氧化铁红褐色沉淀,故选项错误.
故选:B.
点评 本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水.

练习册系列答案
相关题目
15.下列有关说法错误的是( )
| A. | 硫在氧气中燃烧产生明亮的蓝紫色火焰 | |
| B. | “院里开花院外香”,说明分子在不停地运动 | |
| C. | 电解水的实验说明:水由氢和氧两种元素组成 | |
| D. | 合金的硬度比组成它们的纯金属的硬度小 |
19.下列反应以及类型判断合理的是( )
| A. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 氧化还原反应 | |
| B. | 2NaCl+H2CO3═Na2CO3+2HCl 复分解反应 | |
| C. | Cu+2HCl═CuCl2+H2↑ 置换反应 | |
| D. | Ba(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$BaO+H2O 分解反应 |
9.小胡同学在完成硫酸铜晶体的制备和生长实验时,发现将硫酸铜热饱和溶液冷却到室温,可以观察到( )
| A. | 有白色粉末析出 | B. | 有蓝色晶体析出 | C. | 溶液变为无色 | D. | 溶液变为绿色 |
5.氨气极易溶于水,可以还原氧化铜生成水和一种无色气体单质M,该实验装置如图所示.下列分析错误的是( )
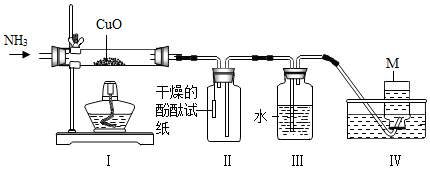

| A. | I中的固体逐渐变为红色 | B. | II中试纸会变成红色 | ||
| C. | 该实验无法证明有水生成 | D. | M可能是N2 |
2.“神州七号”太空舱利用铁酸镍(NiFe2O4)将航天员呼出的二氧化碳(CO2)转化为氧气(O2),而铁酸镍(NiFe2O4)的质量和化学性质都不变化,在该过程中铁酸镍是( )
| A. | 反应物 | B. | 生成物 | C. | 催化剂 | D. | 消毒剂 |
3.下列关于过氧化氢的组成,叙述正确的是( )
| A. | 过氧化氢是由2个氢原子和2个氧原子组成 | |
| B. | 过氧化氢是由氢分子和氧分子组成 | |
| C. | 过氧化氢是由氢气和氧气组成 | |
| D. | 过氧化氢是由氢元素和氧元素组成 |
 科学技术引领创新发展.请回答23题.
科学技术引领创新发展.请回答23题.