题目内容
4.今年6月1日生效的《北京市控制吸烟条例》被称为史上最严控烟条例,香烟中的烟气中所含的尼古丁(化学式为C10H14N2)对人体的毒害作用非常大,试计算:尼古丁中氢元素和氮元素的质量比为1:2(填最简整数比).分析 根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
解答 解:尼古丁中氢元素和氮元素的质量比为(1×14):(14×2)=1:2.
故答案为:1:2.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
14.某兴趣小组发现了一包敞口放置的碱石灰样品,为探究其成分,同学们在实验室对这包碱石灰样品展开了探究.
【查阅资料】①碱石灰是由CaO和NaOH固体混合而成的,通常用于吸收二氧化碳和干燥气体.②CaCl2显中性.
【提出猜想】根据资料,小宏分析碱石灰样品的主要成分可能含有CaO、NaCl、NaOH、Na2CO3、Ca(OH)2、CaCO3.
他认为含有Na2CO3的原因是2NaOH+CO2═Na2CO3+H2O(用化学方程式表示),其他同学否定了NaCl的存在,原因是反应物中不含有氯元素,因此不能生成氯化钠.
【实验探究】小组讨论后设计如下实验进行,请补充探究过程.
【思考与分析】小涛同学经过分析认为步骤③的结论不准确,用化学方程式说明原因Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
【解释与结论】通过以上探究与分析:该碱石灰样品中一定含有Na2CO3、Ca(OH)2,步骤⑤所得溶液中除酚酞外还含有的溶质NaCl、BaCl2、NaOH.
【查阅资料】①碱石灰是由CaO和NaOH固体混合而成的,通常用于吸收二氧化碳和干燥气体.②CaCl2显中性.
【提出猜想】根据资料,小宏分析碱石灰样品的主要成分可能含有CaO、NaCl、NaOH、Na2CO3、Ca(OH)2、CaCO3.
他认为含有Na2CO3的原因是2NaOH+CO2═Na2CO3+H2O(用化学方程式表示),其他同学否定了NaCl的存在,原因是反应物中不含有氯元素,因此不能生成氯化钠.
【实验探究】小组讨论后设计如下实验进行,请补充探究过程.
| 实验步骤及操作 | 实验现象 | 结论 |
| ①取部分该样品于试管中,加少量水 | 无明显放热现象 | 碱石灰样品中不含CaO和NaOH |
| ②继续加足量水,振荡, ③过滤,向白色沉淀中滴加稀盐酸 | 产生白色沉淀 白色沉淀消失,并产生气泡 | 碱石灰样品中一定含有CaCO3 |
| ④从步骤②的试管中取少量上层清液于另一试管中, 向其中滴加过量BaCl2溶液 | 产生白色沉淀 |  |
| ⑤从步骤④的试管中取上层清液于另一试管中, 向其中滴加无色酚酞试液 | 溶液变红色 |
【解释与结论】通过以上探究与分析:该碱石灰样品中一定含有Na2CO3、Ca(OH)2,步骤⑤所得溶液中除酚酞外还含有的溶质NaCl、BaCl2、NaOH.
15.在一定温度下,某物质的饱和溶液一定是( )
| A. | 很稀的溶液 | B. | 很浓的溶液 | ||
| C. | 可以继续溶解该物质 | D. | 不能继续溶解该物质 |
19.如表除去杂质的方法中,正确而且是其最佳方法的是( )
| 选项 | 物质(括号内为杂质) | 除去杂质的方法 |
| A | Cu(NO3)2溶液(AgNO3) | 加过量铜粉,过滤 |
| B | CaCl2溶液(CaCO3) | 加入适量盐酸,再过滤 |
| C | Fe(Zn) | 加足量稀盐酸,过滤 |
| D | CO(CO2) | 通过灼热的氧化铜粉末 |
| A. | A | B. | B | C. | C | D. | D |
16. 甲的溶液可用作化肥、电镀液等,该物质溶解度曲线如图所示,下列说法正确的是( )
甲的溶液可用作化肥、电镀液等,该物质溶解度曲线如图所示,下列说法正确的是( )
 甲的溶液可用作化肥、电镀液等,该物质溶解度曲线如图所示,下列说法正确的是( )
甲的溶液可用作化肥、电镀液等,该物质溶解度曲线如图所示,下列说法正确的是( )| A. | 20℃时,28.6g甲物质中加入50g水,所得溶液质量为78.6g | |
| B. | 甲的溶解度是102.5g | |
| C. | 甲的溶解度随温度升高而增大 | |
| D. | 将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出 |
14.配制稀硫酸的部分操作过程如图所示,其中错误的是( )
| A. |  取浓硫酸 取浓硫酸 | B. |  读取数据 | C. |  稀释 | D. |  装瓶 |
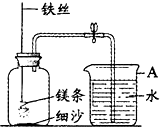 某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%.
某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%.