题目内容
18.合金是重要的金属材料.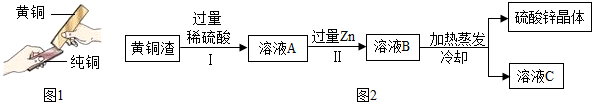
(1)下列物品所使用的主要材料属于合金的是C(填字母序号,下同).
A.青花瓷瓶 B.橡胶充气艇 C.不锈钢锅
(2)生铁是常用的合金,生铁属于混合物(填“纯净物”或“混 合物”).
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图1所示),纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜的硬度大.
(4)黄铜渣中约含 Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质.处理黄铜渣可得到硫酸锌,其主要流程如图2(杂质不溶于水、不参与反应):已知:ZnO+H2SO4═ZnSO4+H2O; CuO+H2SO4═CuSO4+H2OⅡ中反应的化学方程式为H2SO4+Zn═ZnSO4+H2↑、CuSO4+Zn═ZnSO4+Cu.
分析 1)合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;合金具有以下特点:①一定是混合物;②合金中至少有一种金属等.
(2)根据已有的知识进行分析解答,生铁是铁和碳的合金,主要成分是铁,属于混合物,据此解答;
(3)合金要比组成它的纯金属的硬度大解答;
(4)根据金属与酸、盐的溶液反应的规律书写化学方程式.
解答 解:(1)A、青花瓷瓶是用泥土烧制而成的,属于无机非金属材料,故选项错误.
B、橡胶充气艇是用合成橡胶制成的,合成橡胶属于三大合成材料之一,故选项错误.
C、不锈钢锅是用不锈钢制成的,是铁的合金,故选项正确.
故选:C;
(2)生铁是铁和碳的合金,主要成分是铁,属于混合物,故填:混合物;
(3)将纯铜片和黄铜片互相刻画,纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜的硬度大;
故填:黄铜的硬度比纯铜的硬度大.
(4)由于锌排在氢和铜的前面,故锌既可以与酸反应,也可以与硫酸铜反应,反应的化学方程式分别为H2SO4+Zn═ZnSO4+H2↑;CuSO4+Zn═ZnSO4+Cu.
故填:H2SO4+Zn═ZnSO4+H2↑;CuSO4+Zn═ZnSO4+Cu.
点评 本题难度不大,主要考查合金的特征,掌握合金的特征(①一定是混合物;②合金中至少有一种金属等)是正确解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.水是宝贵的自然资源,下列关于水的说法正确的是( )
| A. | 电解水得到的氢气和氧气的体积比为1:2(相同温度和压强下) | |
| B. | 水在自然界不断循环,取之不尽,用之不竭 | |
| C. | 保持水化学性质的最小微粒是水分子 | |
| D. | 为了节约用水,可以直接用工业废水浇灌农田 |
9.下列反应属于中和反应的是( )
| A. | H2SO4+CuO═CuSO4+H2O | B. | Mg+H2SO4═MgSO4+H2↑ | ||
| C. | Ca(OH)2+Na2CO3═2NaOH+CaCO3↓ | D. | Cu(OH)2+2HCl═CuCl2+2H2O |
13.下列实验中,根据有关现象得出结论,不合理的是( )
| 实验操作 | 现象 | 结论 | |
| A | 向某溶液中滴加硫酸铜溶液 | 出现蓝色沉淀 | 该溶液可能是烧碱溶液 |
| B | 将硝酸铵固体溶于水 | 溶液温度降低 | 硝酸铵溶于水吸热 |
| C | 向盛有少量固体的试管中滴加稀盐酸 | 产生气泡 | 该固体一定是碳酸盐 |
| D | 点燃某气体,在火焰上方罩一个干冷的烧杯 | 烧杯内壁出现水珠 | 该气体含氢元素 |
| A. | A | B. | B | C. | C | D. | D |
10. 实验小组探究盐酸和氢氧化钠反应过程中溶液pH及溶液温度变化规律,得到如图所示曲线.下列有关该实验事实的说法正确的是( )
实验小组探究盐酸和氢氧化钠反应过程中溶液pH及溶液温度变化规律,得到如图所示曲线.下列有关该实验事实的说法正确的是( )
 实验小组探究盐酸和氢氧化钠反应过程中溶液pH及溶液温度变化规律,得到如图所示曲线.下列有关该实验事实的说法正确的是( )
实验小组探究盐酸和氢氧化钠反应过程中溶液pH及溶液温度变化规律,得到如图所示曲线.下列有关该实验事实的说法正确的是( )| A. | t2点时刻的溶液能使酚酞试液变红 | |
| B. | 该化学反应发生时需要从外界吸热 | |
| C. | 该实验是将氢氧化钠溶液滴入盐酸中 | |
| D. | t3点时刻溶液中的溶质只有氯化钠 |
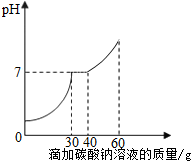 某一盐酸溶液中含有少量氯化钙杂质,为了测定氯化钙的含量,小霞做了如下实验:取30g该盐酸溶液加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10.6%的碳酸钠溶液,同时用电子pH计不断读取反应时的pH,得出如右图所示的关系.求:
某一盐酸溶液中含有少量氯化钙杂质,为了测定氯化钙的含量,小霞做了如下实验:取30g该盐酸溶液加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10.6%的碳酸钠溶液,同时用电子pH计不断读取反应时的pH,得出如右图所示的关系.求: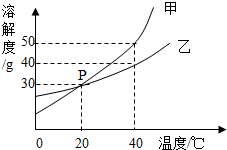 甲、乙两种固体物质的溶解度曲线如图所示.
甲、乙两种固体物质的溶解度曲线如图所示.