题目内容
16.同学们用Na2CO3溶液和浓盐酸来研究简易灭火器的反应原理时,对废液的成分进行探究.上述两种物质发生反应的化学方程式为,由此判断废液中溶质一定有NaCl(NaCl溶液呈中性),设计一个简单的实验确定废液中另一成分是Na2CO3,还是盐酸.(1)甲同学向废液中加入少量氢氧化铜固体,观察到氢氧化铜固体不溶解,溶液颜色不变,确定废液中一定没有盐酸.
(2)用向废液中逐滴加入经过酸化的AgNO3.溶液来确定废液中另一成分是Na2CO3,还是盐酸,此方法不可行的原因NaCl+AgNO3=AgCl↓+NaNO3(用化学方程式说明).
(3)后续实验操作是用pH试纸,测出废液的pH大于 (填大于、等于、或小于)7,确定废液中一定含有Na2CO3.
(4)欲从废液中得到纯净的NaC1,请完成下表格实验方案设计.
| 方案 | 加入试剂 | 分离方法 | 方案评价 |
| 1 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | 不可行,理由是引入了新杂质硝酸钠 |
| 2 | 过量的稀盐酸 | 蒸发结晶 | 可行 |
分析 根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳进行分析;
(1)根据不溶性碱和会与酸反应而溶解进行分析;
(2)根据检验氯离子常用硝酸银,氯化钠和硝酸银会生成氯化银沉淀进行分析;
(3)根据碳酸钠溶液显碱性,pH值大于7进行分析;
(4)除去杂质的原则是:除去杂质的同时不能带入新杂质,原物质的质量可以增加,但是不能减少.
解答 解:碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl(浓)═2NaCl+H2O+CO2↑;
(1)不溶性碱和会与酸反应而溶解,所以向废液中加入少量的氢氧化铜固体,观察到氢氧化铜固体不溶解,溶液颜色不变,确定废液中一定没有盐酸;
(2)检验氯离子常用硝酸银,氯化钠和硝酸银会生成氯化银沉淀,所以用向废液中逐滴加入经过酸化的硝酸银,溶液来确定废液中另一成分是Na2CO3,还是盐酸,此方法不可行的原因:NaCl+AgNO3=AgCl↓+NaNO3;
(3)后续实验操作是用pH试纸,测出废液的pH,碳酸钠溶液显碱性,所以测出的pH值大于7;
(4)不能用硝酸钙除去废液中的碳酸钠,因为硝酸钙和碳酸钠反应能生成碳酸钙沉淀和硝酸钠,在除去碳酸钠的同时,引入了新杂质硝酸钠.
故填:引入了新杂质硝酸钠.
可以用过量的稀盐酸除去碳酸钠,因为碳酸钠和稀盐酸反应能生成氯化钠、水和二氧化碳,盐酸易挥发,过量的盐酸在蒸发过程中能够挥发掉.
故填:稀盐酸.
故答案为:
(1)氢氧化铜固体不溶解,溶液颜色不变;
(2)NaCl+AgNO3=AgCl↓+NaNO3;
(3)用pH试纸 大于;
(4)
| 方案 | 加入试剂 | 分离方法 | 方案评价 |
| 1 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | 不可行,理由是 引入了新杂质硝酸钠 |
| 2 | 过量的 稀盐酸 | 蒸发结晶 | 可行 |
点评 实验是化学的重要组成部分,正确的实验操作是得出科学结论的前提条件之一,因此要学会设计实验、进行实验、分析实验,为得出正确的结论奠定基础.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
4.下列实验方案或操作中,正确的是( )
| A. | 按溶解、过滤、洗涤、蒸发结晶的操作顺序,可分离氯化钾和二氧化锰的混合物 | |
| B. | 用燃烧的木条即可把N2、O2和CO2区别开来 | |
| C. | 测定某溶液pH的操作是:将pH试纸直接插入待测液中,再取出与标准比色卡对照 | |
| D. | 在稀盐酸与氢氧化钠反应后的溶液中滴加酚酞溶液不变色,可断定两者恰好完全反应 |
1.下列物质的性质与用途描述不正确的是( )
| A. | 铜具有导电性--用做电线 | |
| B. | 氮气化学性质不活泼--用做粮食保护气 | |
| C. | 氧气能支持燃烧--用做燃料 | |
| D. | 干冰易升华--用于人工降雨 |
5. 如图是用模型来表示物质发生化学变化过程的微观示意图.该图示所表示的化学反应的基本类型是( )
如图是用模型来表示物质发生化学变化过程的微观示意图.该图示所表示的化学反应的基本类型是( )
 如图是用模型来表示物质发生化学变化过程的微观示意图.该图示所表示的化学反应的基本类型是( )
如图是用模型来表示物质发生化学变化过程的微观示意图.该图示所表示的化学反应的基本类型是( )| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |

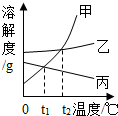 如图为甲、乙、丙三种固体物质在水中的溶解度曲线,请回答
如图为甲、乙、丙三种固体物质在水中的溶解度曲线,请回答