题目内容
19.面粉是制作面包的主要原料,判断面粉品质优劣的测定项目通常有:淀粉含量.灰分含量及面粉酸度等.面粉酸度的度数是指中和100克面粉中含有的酸所耗用质量分数为0.4%氢氧化钠溶液的毫升数.面粉酸度与面粉品质的关系如表.面粉酸度与面粉品质的关系表
| 面粉酸度 | <2° | 2°-4.5° | >4.5° |
| 面粉品质 | 新鲜面粉 | 陈年面粉 | 霉变面粉 |
(1)为检测某种面粉中是否含有淀粉,取一定质量的面粉放入烧杯中,加入适量的蒸馏水,搅拌,缓缓加热,溶解,取少量试液置于试管中,滴加碘液,若溶液变蓝色,就说明该面粉中含有淀粉.
(2)称取5克某种面粉放入锥形瓶,加入适量蒸馏水搅匀,为减小实验误差,现用质量分数为0.004%氢氧化钠溶液来进行测定,恰好完全反应时共消耗22毫升氢氧化钠溶液.计算该面粉的酸度4.4°;,并判断其品质(忽略两种氢氧化钠溶液密度的差异)陈年面粉.
分析 淀粉遇碘变蓝色;
根据表中提供的信息和相关方面的数据可以进行相关方面的计算和判断.
解答 解:(1)为检测某种面粉中是否含有淀粉,取一定质量的面粉放入烧杯中,加入适量的蒸馏水,搅拌,缓缓加热,溶解,取少量试液置于试管中,滴加碘液,若溶液变蓝色,就说明该面粉中含有淀粉.
故填:变蓝色.
(2)用质量分数为0.004%氢氧化钠溶液来进行测定,恰好完全反应时共消耗22mL氢氧化钠溶液,则用质量分数为0.4%氢氧化钠溶液时,需要氢氧化钠溶液的体积是0.22mL;
则100g该种面粉消耗质量分数为0.4%氢氧化钠溶液的体积是:0.22mL×20=4.4mL,
该面粉的酸度是4.4°,是陈年面粉.
故填:4.4°;陈年面粉.
点评 本题主要考查简单的计算,计算时要注意规范性和准确性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.在氧化还原反应中,得到氧的物质是还原剂;失去氧的物质是氧化剂. 有反应:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,此反应中还原剂是( )
| A. | Al | B. | Fe | C. | Fe2O3 | D. | Al2O3 |
7.已知某无色溶液中含有SO42-、Cl-、NO3-三种阴离子,则溶液中大量存在的阳离子是( )
| A. | Ba2+ | B. | Fe3+ | C. | Ag+ | D. | Mg2+ |
14.下列各组仪器,常用于物质分离的是( )
①漏斗 ②容量瓶 ③温度计 ④分液漏斗 ⑤天平
⑥量筒 ⑦胶头滴管 ⑧蒸馏烧瓶 ⑨集气瓶.
①漏斗 ②容量瓶 ③温度计 ④分液漏斗 ⑤天平
⑥量筒 ⑦胶头滴管 ⑧蒸馏烧瓶 ⑨集气瓶.
| A. | ①④⑧ | B. | ②⑥⑦⑨ | C. | ①③⑦ | D. | ④⑤⑥⑧ |
4.在化学反应Na2S2O3+4Cl2+5H2O=2NaHSO4+□X 中,生成物X的溶液是一种常见的物质.关于X,下列说法错误的是( )
| A. | X的化学式是HCl | B. | X中氯元素质量分数大于50% | ||
| C. | 加水稀释X溶液时其pH变小 | D. | X溶液可用来除铁锈 |
15.以下是某同学进行的两个关于金属的探究实验.
【实验一】探究镁条与稀盐酸反应过程中的能量变化以及反应速率的变化
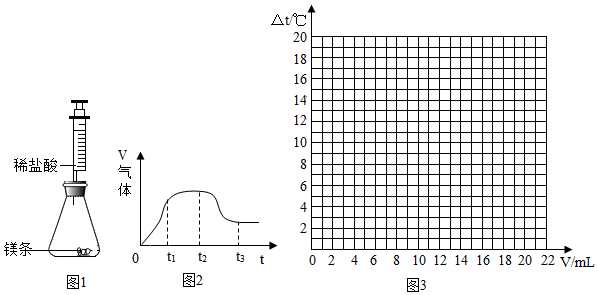
(1)实验前需对镁条进行打磨,目的是去除表面的氧化镁等杂质.
(2)检查图1 装置的气密性
(3)将镁条放入锥形瓶中,将注射器中的稀盐酸快速推入锥形瓶中.若稀盐酸是缓慢推入的,可能造成的后果是生成的热量会随之散失到周围的空气中,造成反应过程中温度几乎不变.
(4)观察注射器活塞运动变化情况,绘制出注射器内收集到的气体体积与时间关系的图象如图2 所示.
则t1~t2时间内反应速率逐渐减慢的主要原因是盐酸的浓度减小; t2~t3时间内注射器内气体体积逐渐减少的原因温度降低,气体体积减小.
【实验二】探究实验一反应后所得溶液的酸碱性
(1)甲同学用pH 试纸测定充分反应后锥形瓶中溶液的酸碱性,发现pH 小于7,说明甲同学所得溶液呈酸性(选填“酸”、“碱”或“中”).
甲同学:猜想Ⅰ:盐酸过量,使溶液pH 小于7;猜想Ⅱ:溶液pH 小于7.
为验证猜想Ⅱ,甲同学测定了该溶液的酸碱性,显弱酸性.
(2)乙同学重复甲同学实验时,发现反应后所得溶液pH 大于7,发现实验与甲同学实验不同的是,反应后的锥形瓶中镁条有剩余.乙同学猜想可能是镁与热水反应生成了碱性物质.乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁条与水反应的化学方程式Mg+2H2O(热)═Mg(OH)2+H2↑.
【拓展延伸】中和反应也会放出热量.某化学小组初步探究“氢氧化钠溶液和稀盐酸发生中和反应时,溶液温度的变化情况”.
【实验用品】10%的氢氧化钠溶液、10%的稀盐酸、温度计…
【实验过程】在一定体积的10%的氢氧化钠溶液中滴加10%的稀盐酸(室温下),反应中溶液温度的变化如下:
(1)试在图3中绘出溶液温度变化与加入稀盐酸体积之间的关系图.
(2)写出该中和反应的化学方程式HCl+NaOH=NaCl+H2O.
(3)其他条件不变,若改用20%的盐酸进行滴加,结合对上述曲线分析,大胆猜想新曲线最高点的位置(不考虑密度比热容及热量散失等影响因素).
①横坐标及猜想理由:5,当恰好完全反应时,放出热量的最大值与原实验相同,此时所需20%的盐酸的体积是原来的二分之一;
②纵坐标及猜想理由:大于18.2的值,当恰好完全反应时,放出热量的最大值与原实验相同,此时实验总质量比原实验小,所以△t最大值大于18.2℃.
【实验一】探究镁条与稀盐酸反应过程中的能量变化以及反应速率的变化

(1)实验前需对镁条进行打磨,目的是去除表面的氧化镁等杂质.
(2)检查图1 装置的气密性
(3)将镁条放入锥形瓶中,将注射器中的稀盐酸快速推入锥形瓶中.若稀盐酸是缓慢推入的,可能造成的后果是生成的热量会随之散失到周围的空气中,造成反应过程中温度几乎不变.
(4)观察注射器活塞运动变化情况,绘制出注射器内收集到的气体体积与时间关系的图象如图2 所示.
则t1~t2时间内反应速率逐渐减慢的主要原因是盐酸的浓度减小; t2~t3时间内注射器内气体体积逐渐减少的原因温度降低,气体体积减小.
【实验二】探究实验一反应后所得溶液的酸碱性
(1)甲同学用pH 试纸测定充分反应后锥形瓶中溶液的酸碱性,发现pH 小于7,说明甲同学所得溶液呈酸性(选填“酸”、“碱”或“中”).
甲同学:猜想Ⅰ:盐酸过量,使溶液pH 小于7;猜想Ⅱ:溶液pH 小于7.
为验证猜想Ⅱ,甲同学测定了该溶液的酸碱性,显弱酸性.
(2)乙同学重复甲同学实验时,发现反应后所得溶液pH 大于7,发现实验与甲同学实验不同的是,反应后的锥形瓶中镁条有剩余.乙同学猜想可能是镁与热水反应生成了碱性物质.乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁条与水反应的化学方程式Mg+2H2O(热)═Mg(OH)2+H2↑.
【拓展延伸】中和反应也会放出热量.某化学小组初步探究“氢氧化钠溶液和稀盐酸发生中和反应时,溶液温度的变化情况”.
【实验用品】10%的氢氧化钠溶液、10%的稀盐酸、温度计…
【实验过程】在一定体积的10%的氢氧化钠溶液中滴加10%的稀盐酸(室温下),反应中溶液温度的变化如下:
| 加入稀盐酸的体积(V)/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度的变化 (△t)/℃ | 0 | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 | 12.9 |
(2)写出该中和反应的化学方程式HCl+NaOH=NaCl+H2O.
(3)其他条件不变,若改用20%的盐酸进行滴加,结合对上述曲线分析,大胆猜想新曲线最高点的位置(不考虑密度比热容及热量散失等影响因素).
①横坐标及猜想理由:5,当恰好完全反应时,放出热量的最大值与原实验相同,此时所需20%的盐酸的体积是原来的二分之一;
②纵坐标及猜想理由:大于18.2的值,当恰好完全反应时,放出热量的最大值与原实验相同,此时实验总质量比原实验小,所以△t最大值大于18.2℃.