题目内容
20. 某化学兴趣小组的同学要利用课余时间,在实验室进行一些力所能及的探究活动,请你参加并协助他们完成部分探究任务.
某化学兴趣小组的同学要利用课余时间,在实验室进行一些力所能及的探究活动,请你参加并协助他们完成部分探究任务.(1)宁宁要用稀盐酸清除铝壶内附着的水垢(主要成分是碳酸钙),反应的化学方程式为:2HCl+CaCO3=CaCl2+H2O+CO2↑.除垢时要注意控制盐酸的用量和浸泡时间,其理由是(用化学方程式表示)2Al+6HCl=2AlCl3+3H2↑.
(2)佳佳要通过电解水的实验来验证水的组成.为了增强水的导电性,他向水中加入少量氢氧化钠配制约500毫升溶液,全部倒入如图所示的装置中进行电解.接通电源后,他看到a管产生一定量的气体,一段时间后又看到b管产生一定量的气体.佳佳要检b验试管中的气体,请告诉他正确的操作方法:用带火星的木条检验,木条复燃,证明是氧气.请用化学方程式表示佳佳检验了两种气体后得出的结论2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,并分析得出有关水的组成的正确结论.
(3)经测定佳佳开始电解时的水样为500g 2%的氢氧化钠溶液,电解实验结束后,溶液中溶质的质量分数变为2.5%,请帮佳佳完成以下计算:①她共电解掉了多少克水;②产生氢气多少克?
(4)莉莉准备做中和反应的实验.她采纳了佳佳的建议,量取了5毫升,佳佳电解实验后,剩余的水样于洁净的试管中,滴入几滴酚酞溶液后变成红色,再用胶头滴管慢慢滴入稀盐酸同时不断振荡,直到溶液红色消失.至此,莉莉得出了结论:试管中的中和反应恰好达到终点的.针对莉莉的操作,佳佳提出一些问题,请帮莉莉做出合理的解答.
①做酸碱中和反应实验时,加酚酞试液的作用是指示酸与碱恰好完全反应.
②稀盐酸用胶头滴管滴入而不是直接倒入的原因是防止液体溅出.
③要证明莉莉的实验结论是否正确,应进行的实验操作是取样品加入锌粒,观察是否产生气泡.
④经测定,莉莉所得溶液的PH<7.则其中除酚酞外的溶质有NaCl、HCl.
分析 (1)根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,铝和盐酸反应生成氯化铝和氢气进行分析;
(2)根据氢氧化钠是电解质,可以增强溶液的导电性,水在通电的条件下生成氢气和氧气,正氧负氢,氧气有助燃性进行分析;
(3)根据溶液电解前后溶质质量不变进行分析;
(4)①根据酸碱指示剂可以指示酸碱反应的情况进行分析;
②根据胶头滴管是少量液体的滴加仪器进行分析;
③根据盐酸会与活泼金属反应生成氢气进行分析;
④根据pH<7的溶液中含有盐酸和生成的氯化钠进行分析.
解答 解:(1)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:2HCl+CaCO3=CaCl2+H2O+CO2↑,铝和盐酸反应生成氯化铝和氢气,化学方程式为:2Al+6HCl=2AlCl3+3H2↑;
(2)通过电解水的实验来验证水的组成,为了增强水的导电性,他向水中加入少量氢氧化钠配制约500毫升溶液,全部倒入如图所示的装置中进行电解.接通电源后,他看到a管产生一定量的气体,一段时间后又看到b管产生一定量的气体.佳佳要检b验试管中的气体,请告诉他正确的操作方法:用带火星的木条检验,木条复燃,证明是氧气,用化学方程式表示佳佳检验了两种气体后得出的结论2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,并分析得出有关水的组成的正确结论;
(3)溶液电解前后溶质质量不变,所以电解掉水的质量为:500g-$\frac{500g×2%}{2.5%}$=100g,产生氢气的质量为:100g×$\frac{2}{18}$=11.1g;
(4)①做酸碱中和反应实验时,加酚酞试液的作用是指示酸与碱恰好完全反应;
②稀盐酸用胶头滴管滴入而不是直接倒入的原因是防止液体溅出;
③要证明莉莉的实验结论是否正确,应进行的实验操作是取样品加入锌粒,观察是否产生气泡;
④经测定,莉莉所得溶液的PH<7.则其中除酚酞外的溶质有NaCl、HCl.
故答案为:(1)2HCl+CaCO3=CaCl2+H2O+CO2↑,2Al+6HCl=2AlCl3+3H2↑;
(2)增强水的导电性,a管产生一定量的气体,b管产生一定量的气体.用带火星的木条检验,木条复燃,证明是氧气,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
(3)100g,11.1g;
(4)①指示酸与碱恰好完全反应;
②防止液体溅出;
③取样品加入锌粒,观察是否产生气泡;
④NaCl、HCl.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的提示进行解答.

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案| A. | 青蒿素属于氧化物 | |
| B. | 青蒿素的相对分子质量是 282 | |
| C. | 青蒿素由 15 个碳原子、22 个氢原子和 5 个氧原子构成 | |
| D. | 青蒿素中 C、H、O 三种元素的质量比为 15:22:5 |
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | 氧化铜 | 氯化钠 | 加水溶解、过滤、洗涤干燥 |
| B | 氧气 | 水蒸气 | 通过盛有浓硫酸的洗气瓶 |
| C | 氯化钙溶液 | 稀盐酸 | 加入过量的石灰石,过滤 |
| D | CuSO4溶液 | FeSO4 | 加入足量铜粉,过滤 |
| A. | A | B. | B | C. | C | D. | D |

(1)装置及反应原理探究
①B装置中浓硫酸的作用为干燥一氧化碳.
②说明CO能还原CuO的现象为C装置中黑色粉末变成红色,D装置中澄清石灰水变浑浊.
③上述整套装置中发生的化学反应,其中属于化合反应的化学方程式2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2.(不考虑CO2和H2O的反应.)
(2)产物成分探究
[查阅资料]Ⅰ、一氧化碳还原氧化铜.除生成铜外还可能生成氧化亚铜(Cu2O)
Ⅱ、Cu2O为不溶于水的红色固体
Ⅲ、Cu2O+H2SO4═Cu SO4+Cu+H2O
[提出问题]红色固体含有什么物质?
[猜想假设]假设一:红色固体只含Cu
假设二:红色固体只含Cu2O
假设三:红色固体含有Cu2O和Cu.
[实验验证]该小组为验证上述假设,取少量红色固体,加到足量稀硫酸中,观察到溶液变为蓝色,红色固体部分溶解.
[实验结论]根据上述实验结果,可知红色固体中一定含有Cu2O.
[数据处理]为进一步确定红色固体的成分,甲、乙两同学分别称取各自实验后的一定质量的红色固体,加到足量稀硫酸中使其充分反应,经过滤、洗涤、干燥后,称量剩余红色固体质量如表,请完善表中内容.
| 实验人员 | 红色固体(g) | 剩余红色固体(g) | 实验结论 |
| 甲 | 7.2 | 3.2 | 假设二成立 |
| 乙 | 4.08 | 2.48 | 假设三成立 |
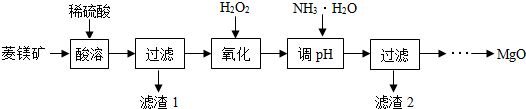
(1)酸溶之前要将矿石粉碎的目的是增大接触面积,使反应更快更充分.稀硫酸需要过量的目的是将碳酸镁和碳酸亚铁完全反应.酸溶步骤中碳酸镁溶解的反应方程式为MgCO3+H2SO4═MgSO4+CO2↑+H2O.
(2)已知Mg2+、Fe2+和Fe3+在溶液中遇到氨水均可以转化成难溶性碱沉淀,开始沉淀和沉淀完全的pH如表:
| Mg2+ | Fe2+ | Fe3+ | |
| 开始沉淀 | 9.4 | 7.9 | 2.7 |
| 沉淀完全 | 12.4 | 9.6 | 3.7 |
(3)加氨水调节溶液的PH范围为控制反应只生成氢氧化铁沉淀而不生成氢氧化镁沉淀.
(4)滤渣2的化学式是Fe(OH)3.
| A. | CO2 (CO)--足量的氧气,点燃 | |
| B. | CaO (CaCO3)--高温煅烧 | |
| C. | N2(O2)--足量的灼热铜网 | |
| D. | KCl粉末(MnO2)--加水溶解,过滤,蒸发结晶 |
| A. | 取反应后的滤液观察,滤液不可能呈蓝色 | |
| B. | 取反应后的滤液滴加稀盐酸,有白色沉淀产生 | |
| C. | 取滤渣滴加稀硫酸,一定无气泡产生 | |
| D. | 滤渣中的物质至少有两种 |
