题目内容
9.几千年前,人类就用木炭作为还原剂进行金属冶炼.木炭在高温条件下还原氧化铜所生成的气体产物可能是一氧化碳,或二氧化碳,或二者的混合物.小科为此用如图装置(铁架台已略去)进行探究: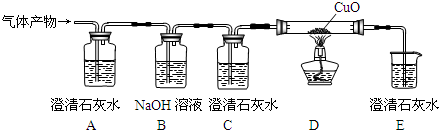
(1)装置中B有什么作用?除去二氧化碳.
(2)如果要证明气体产物中有二氧化碳,应观察到什么现象?A中的澄清的石灰水变浑浊.
(3)如果要证明气体产物中只有一氧化碳,应观察到什么现象?A中的澄清石灰水不变浑浊,D中的黑色氧化铜变红色,E中的石灰水变浑浊.写出此时D中反应的化学方程式CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2.
分析 (1)根据除杂的方法进行分析;
(2)根据二氧化碳和氢氧化钙的反应进行分析;
(3)根据一氧化碳、二氧化碳的性质及化学方程式的书写分析;
解答 解:(1)装置中B是让气体通过氢氧化钠溶液,目的是除去其中的二氧化碳气体;
(2)如果要证明气体产物中有二氧化碳,我们看到的现象是A中的澄清的石灰水变浑浊;
(3)如果要证明气体产物中只有一氧化碳,应观察到什么现象是A中的澄清石灰水不变浑浊,D中的黑色氧化铜变红色,E中的石灰水变浑浊;D中反应是氧化铜与一氧化碳在加热的条件下生成铜和二氧化碳;其反应的化学方程式为:CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2.
故答案为:(1)除去二氧化碳;(2)A中的澄清的石灰水变浑浊;(3)A中的澄清石灰水不变浑浊,D中的黑色氧化铜变红色,E中的石灰水变浑浊;CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2.
点评 本题考查二氧化碳、一氧化碳的性质及与物质的反应,化学方程式的书写等,题目难度不大.

练习册系列答案
相关题目
19.氢氧化铜、氢氧化铁、氢氧化锌的混合物若干,与10%的硫酸溶液完全反应,生成3.6g的水,则已反应的稀硫酸的质量为( )
| A. | 196g | B. | 49g | C. | 100g | D. | 98g |
17.菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中MgCO3的含量,学习小组进行了实验研究.取10克菱镁矿样品,向其中逐滴加入未知质量分数的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如表:
(假设菱镁矿中的杂质不溶于水,不与酸发生反应.)
(1)10克菱镁矿与H2SO4溶液完全反应,生成CO2的质量为4.4g.
(2)该菱镁矿中MgCO3的质量分数是多少?
(3)该实验研究中所用H2SO4溶液的溶质质量分数是多少?
| 加入H2SO4溶液的质量/g | 50 | 100 | 150 | 200 |
| NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
(1)10克菱镁矿与H2SO4溶液完全反应,生成CO2的质量为4.4g.
(2)该菱镁矿中MgCO3的质量分数是多少?
(3)该实验研究中所用H2SO4溶液的溶质质量分数是多少?
4.金属活动性顺序在科学研究中有重要应用.已知M、铁、R三种金属与其盐溶液之间能发生如下反应M+FeSO4═MSO4+Fe; Fe+RSO4═FeSO4+R.则三种金属的活动性顺序从强到弱的排列是( )
| A. | M>Fe>R | B. | R>Fe>M | C. | Fe>R>M | D. | R>M>Fe |
1.下列对实验现象的叙述正确的是( )
| A. | 铁丝在空气中燃烧,火星四射 | B. | 碳在氧气中燃烧发出红光 | ||
| C. | 硫在空气中燃烧发出蓝紫色火焰 | D. | 磷在氧气中燃烧,产生白烟 |
 某化学活动小组探究金属的反应规律.
某化学活动小组探究金属的反应规律. 如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.若液体X选用双氧水,则固体Y可以选用二氧化锰;若固体Y氢氧化钠,则液体X可选用水.(两空均要求选用纯净物)
如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.若液体X选用双氧水,则固体Y可以选用二氧化锰;若固体Y氢氧化钠,则液体X可选用水.(两空均要求选用纯净物) 现代生活中,人们越来越注意微量元素的摄入.血红蛋白中的铁是人体内氧的输送者,缺铁易患贫血.
现代生活中,人们越来越注意微量元素的摄入.血红蛋白中的铁是人体内氧的输送者,缺铁易患贫血.