题目内容
6.从H、O、N、K、Mn、Fe、Ca、S八种元素中选择适当的元素,用离子符号或化学式或化学方程式填空:(1)2个硝酸根离子2NO3-;
(2)1个氢分子H2;
(3)亚铁离子Fe2+;
(4)+2价的钙元素$\stackrel{+2}{Ca}$;
(5)实验室用一种液体制取氧气:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(6)剧烈燃烧,火星四射的化学反应:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
(7)用一种暗紫色的固体加热制取氧气:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(8)生成一种有刺激性气味气体的化学反应:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.
分析 本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
解答 解:(1)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字,故2个硝酸根离子可表示为:2NO3-;
(2)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则1个氢分子可表示为H2;
(3)由亚铁离子的名称可知其中的铁的化合价为+2,说明1个亚铁离子带有2个单位的正电荷,按照离子符号的书写方法可得Fe2+;
(4)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以+2价的钙元素,故可表示为:$\stackrel{+2}{Ca}$;
(5)双氧水在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(6)铁丝在氧气中剧烈燃烧火星四射,有黑色固体生成,反应的化学方程式为:3Fe+2O2 $\frac{\underline{\;点燃\;}}{\;}$ Fe3O4.
(7)高锰酸钾是暗紫色固体,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(8)硫在氧气中燃烧生成有刺激性气味的气体二氧化硫,反应的化学方程式是S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
故答案为:(1)2NO3-;(2)H2;(3)Fe2+;(4)$\stackrel{+2}{Ca}$;(5)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.(6)3Fe+2O2 $\frac{\underline{\;点燃\;}}{\;}$ Fe3O4.(7)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;(8)S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
点评 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.

【活动与探究一】用对比实验方法探究二氧化碳的性质.
| 实验一 | 实验二 |
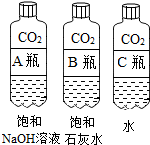 | 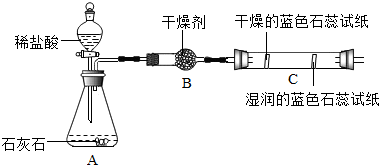 |
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色,结论是CO2+H2O=H2CO3(用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
| 实验三 | 实验四 |
 |  |
【活动与探究三】定量测定空气中氧气的含量.
| 实验五 | |
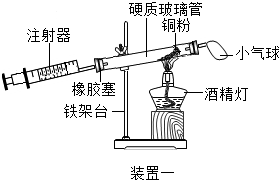 | 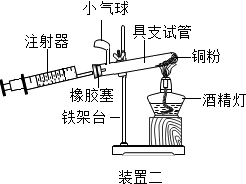 |
根据下表提供的实验数据,完成下表:
| 硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 30mL | 20mL | 12mL | 16% |
| A. | 汽油挥发 | B. | 水的电解 | C. | 瓷碗破碎 | D. | 干冰升华 |
| A. | 去超市购物,用布质购物袋 | B. | 网上购买大量闲置物品 | ||
| C. | 节假日随父母出游,经常开私家车 | D. | 外出就餐,超量点菜 |
| A. |  氧气验满 | B. |  收集二氧化碳气体 | ||
| C. |  倾倒液体 | D. |  检查装置气密性 |
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a、可能与硫酸的溶质质量分数有关;
b、可能与锌的表面积有关;
c、…
【设计并实验】
若要验证与稀硫酸的溶质质量分数有关,请你将实验方案填写在下表中.
提示:锌和稀硫酸的反应速度比较快,很难通过观察气泡的产生速度准确判断与稀硫酸的溶质质量分数的关系.所以不建议用这种方法辨别之.
| 观察或测定的量 | 需要控制的实验条件 | 实验步骤 | 实验结果与结论 |
| 时间 | 1分钟 | 2分钟 | 3分钟 | 4分钟 | 5分钟 | 6分钟 |
| H2的体积 | 3.1mL | 19.8mL | 28.6mL | 35.2mL | 41.0mL | 45.8mL |

请解释反应3分钟以后,速度变慢的原因:3分钟后,随着硫酸被消耗,硫酸溶质质量分数变小,反应速度又逐渐减慢.
| A. |  放置一瓶氧气 | B. |  稀释42mL浓硫酸 | ||
| C. |  氢气的检验 | D. |  检验氧气 |
| A. | 葡萄糖的相对分子质量是180 | |
| B. | 葡萄糖中碳、氢、氧三种元素的质量比为:6:1:8 | |
| C. | 葡萄糖中氢元素的质量分数是6.67% | |
| D. | 葡萄糖由6个碳原子、12个氢原子和6个氧原子构成 |
| 选项 | 实验目的 | 所用试剂或方法 |
| A | 区分真金和假金(铜锌合金) | 用硫酸铝溶液鉴别 |
| B | 除去硫酸亚铁溶液中含有的硫酸铜 | 加足量的铁粉,过滤 |
| C | 除去CO2中的CO气体 | 在氧气中点燃 |
| D | 除去氯化钠溶液中的碳酸钠溶液 | 加入足量稀盐酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |