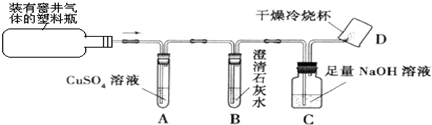
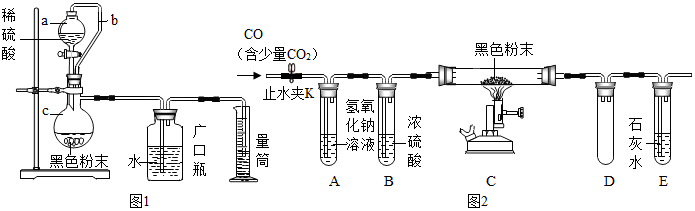
题目内容
20.完成下列化学方程式:(1)生产玻璃的反应原理是:Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑、CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$ CaSiO3+CO2↑(2)硝酸铵与熟石灰混合施用会降低肥效,原因是2NH4NO3+Ca(OH)2═Ca(NO3)2+2NH3↑+2H2O.
(3)科学家采取“组合转化”技术,将CO2和H2以一定比例混合,在一定条件下反应,生成一种重要的化工原料和水.请在括号中填写该化工原料的化学式:2CO2+6H2═C2H4+4H2O
(4)为了减缓大气中的CO2含量的增加,目前以下建议中可行的是①③.
①开发太阳能、水能、风能、地热等新能源;
②禁止使用煤、石油、天然气等矿物燃料;
③大量植树造林,禁止乱砍滥伐.
分析 (1)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
(2)硝酸铵与熟石灰混合生成硝酸钙、水和氨气,写出反应的化学方程式即可.
(3)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物的化学式.
根据减缓大气中CO2含量的增加的措施,进行分析判断.
解答 解:(1)碳酸钠、碳酸钙和二氧化硅在高温条件下反应,分别生成硅酸钠和二氧化碳、硅酸钙和二氧化碳,反应的化学方程式分别为:Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,CaCO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑.
(2)硝酸铵与熟石灰混合生成硝酸钙、水和氨气,反应的化学方程式为:2NH4NO3+Ca(OH)2═Ca(NO3)2+2NH3↑+2H2O.
(3)根据反应的化学方程式,反反应物中总共有2个碳原子、4个氧原子和12个氢原子,而生成物中只有8个氢原子和4个原子,还少2个碳原子和4个氢原子,则每个未知分子由2个碳原子和4个氢原子构成,因此未知物质的化学式为C2H4.
(4)①开发太阳能、水能、风能、地热等新能源,能减少二氧化碳的排放,减缓大气中CO2含量的增加;
②目前的能源结构中,是以化石燃烧为主的,禁止使用煤、石油、天然气等矿物燃料根本不现实;
③大量植树造林,禁止乱砍滥伐,植物的光合作用能吸收大量的二氧化碳,使降低空气里二氧化碳含量,减缓大气中CO2含量的增加.
故答案为:(1)Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$ CaSiO3+CO2↑;
(2)2NH4NO3+Ca(OH)2═Ca(NO3)2+2NH3↑+2H2O;
(3)C2H4;①③.
点评 本题难度不大,掌握化学方程式的书写方法、质量守恒定律、减缓大气中CO2含量的增加的措施等是正确解答本题的关键.

| A. | 高锰酸钾、氮气 | B. | 洁净的空气、氧气 | C. | 铝、二氧化碳 | D. | 硫粉、铁粉 |
【查阅资料】
①NaN3受撞击会迅速分解生成Na、N2,写出该反应的化学方程式2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑.
②NaN3遇盐酸、H2SO4溶液无气体生成;
③碱石灰是CaO和 NaOH的混合物;
④NaN3工业上制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X;则X的化学式为NH3.
【问题探究】
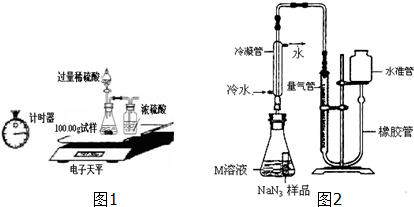
(一)测定某工业级NaN3样品中Na2CO3的质量分数
(1)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示)2NaOH+CO2═Na2CO3+H2O;
(2)某同学设计如图1装置测出碳酸钠的质量分数,其实验数据记录如下:
| 称量项目 | 称量时间 | 质量(g) |
| 试样 | 100.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 339.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 339.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 339.00 |
②若无浓硫酸的洗气装置,会使测定的结果偏大(填“偏大”、“偏小”或“不变”);
③利用表中数据计算出碳酸钠的质量分数为5.3%.
【问题探究】
(二)测定某工业级样品中NaN3的质量分数
小谈同学精确称量0.140g NaN3样品,设计如图2装置测定其质量分数.
已知2NaN3→3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(1)检查该装置气密性的方法是:连接好装置,从水准管注水,左右两边出现稳定的液面差,说明气密性良好.
(2)使用冷水冷凝的目的是:使水蒸气液化.
(3)倾斜锥形瓶使小试管中的NaN3样品与M溶液接触充分反应. 常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是A(填字母序号).
A.100mL B.1L C.2L
(4)计算工业级样品中NaN3的质量分数(写出计算过程,结果保留0.1%).
| A. | 用过滤的方法将硬水转化为软水 | |
| B. | 用燃着的木条区分二氧化碳和氮气 | |
| C. | 用燃烧木炭的方法制备纯净的二氧化碳 | |
| D. | 用MnO2来区别水和双氧水 |