题目内容
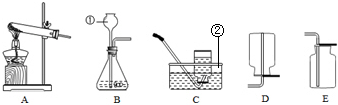
16.实验室常用下列装置来制取气体:(1)写出图中有标号仪器的名称:①长颈漏斗②水槽
(2)若用高锰酸钾制取氧气时,所用发生装置为A,还需补充的一项操作是在试管口处放一团棉花,发生反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)二氧化碳气体密度比空气大,易溶于水.实验室常用大理石与稀盐酸在常温下反应制取CO2,可选用的制取装置是B.
(4)用双氧水和二氧化锰来制取氧气时,在操作过程中,刚开始时锥形瓶内装入二氧化锰,长颈漏斗内倒入过氧化氢溶液,有同学提议将长颈漏斗换成分液漏斗,其优点是可以控制反应的速率.化学课程标准中指出通过实验激发学生学习化学的兴趣和培养学生的科学探究能力,并提供了有关过氧化氢分解制氧气的实验探讨,内容如下:“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣.
【提出问题】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
【实验探究】
| 实验步骤 | 实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象. | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象. | 试管中均产生气泡,带火星木条均复燃 |
| III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag. | / |
| IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象. | / |
(1)A中产生的气体是氧气;
(2)实验II、III证明:氧化铁的质量和化学性质在反应前后均没有发生变化,可以作过氧化氢分解的催化剂.
(3)写出氧化铁催化过氧化氢分解的化学方程式2H2O2$\frac{\underline{\;Fe_{2}O_{3}\;}}{\;}$2H2O+O2↑.
【实验评价】
(1)实验设计IV的目的是氧化铁与二氧化锰哪一个更适合做过氧化氢分解生成氧气的催化剂;
(2)若实验IV观察到D试管中产生气泡的速率更快,由此你可以得到的结论是二氧化锰更适合做过氧化氢分解生成氧气的催化剂.
【实验拓展】
查阅资料得知,CuO、CuSO4、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂.
下列有关催化剂的说法中正确的是B.
A、MnO2只能作过氧化氢溶液分解的催化剂
B、同一个化学反应可以有多种催化剂
C、催化剂只能加快化学反应的速率
D、用作催化剂的物质不可能是其他反应的反应物或生成物
E、酶是一种重要的生物催化剂,它属于糖类.
分析 (1)依据常用仪器名称作答;
(2)依据制氧气应注意的问题作答;依据书写化学方程式的要领作答;
(3)实验室制取二氧化碳,属于固液反应,不需加热;
(4)根据温下用过氧化氢溶液在实验室中制氧气是固体与液体反应,不需加热解答;根据分液漏斗的特点分析说明;
【实验结论】(1)根据氧气具有助燃性,能使带火星木条复燃进行解答;
(2)根据实验Ⅱ、Ⅲ证明:氧化铁的质量和化学性质在反应前后均没有发生变化,可以作过氧化氢分解的催化剂进行解答;
(3)根据氧化铁催化过氧化氢分解生成水和氧气进行解答;
【实验评价】(1)根据二氧化锰也能做过氧化氢分解生成氧气的催化剂进行解答;
(2)根据若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是二氧化锰更适合做过氧化氢分解生成氧气的催化剂进行解答;
【实验拓展】根据催化剂的含义进行解答.
解答 解:
(1)仪器①的名称是长颈漏斗;②是水槽;
(2)若用高锰酸钾制取氧气,为防止加热时高锰酸钾进入到导管,A装置还需在试管口处放一团棉花;反应的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)实验室制取二氧化碳,属于固液反应,不需加热;应选择的气体发生装置为:B;
(4)常温下用过氧化氢溶液在实验室中制氧气是固体与液体反应,不需加热,在操作过程中,刚开始时锥形瓶内装入二氧化锰;长颈漏斗内倒入过氧化氢溶液;将长颈漏斗换成了分液漏斗,分液漏斗可以定量控制液体的用量,其优点是可以控制反应的速率;
【实验结论】(1)氧气具有助燃性,能使带火星木条复燃,所以有实验现象A试管中产生气泡,带火星木条复燃,可知A中产生的气体是氧气;故填:氧气;
(2)实验Ⅱ、Ⅲ证明:氧化铁的质量和化学性质在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;故填:质量;化学性质;
(3)氧化铁催化过氧化氢分解生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;Fe_{2}O_{3}\;}}{\;}$2H2O+O2↑;
【实验评价】(1)二氧化锰也能做过氧化氢分解生成氧气的催化剂,所以设计实验Ⅳ的目的是氧化铁与二氧化锰哪一个更适合做过氧化氢分解生成氧气的催化剂;故填:氧化铁与二氧化锰哪一个更适合做过氧化氢分解生成氧气的催化剂;
(2)若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是二氧化锰更适合做过氧化氢分解生成氧气的催化剂;故填:二氧化锰更适合做过氧化氢分解生成氧气的催化剂;
【实验拓展】
A.MnO2不只能作为氧化氢溶液分解的催化剂,还可以作其他反应的催化剂,故A错误;
B.根据题目的信息可知同一个化学反应可以有多种催化剂,故B正确;
C.催化剂不只是加快化学反应的速率,还能减慢化学反应的速率,故C错误;
D.用作催化剂的物质可能是其它反应的反应物或生成物,例如二氧化锰是高锰酸钾受热分解制氧气的生成物,故D错误;
E、酶是一种重要的生物催化剂,它属于蛋白质,故E错误.
故选:B.
答案:
(1)①长颈漏斗;②水槽;
(2)A;在试管口处放一团棉花;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)B;
(4)二氧化锰;过氧化氢溶液;可以控制反应的速率;
【实验结论】(1)氧气;
(2)质量;化学性质;
(3)2H2O2$\frac{\underline{\;Fe_{2}O_{3}\;}}{\;}$2H2O+O2↑;
【实验评价】
(1)氧化铁与二氧化锰哪一个更适合做过氧化氢分解生成氧气的催化剂;
(2)二氧化锰更适合做过氧化氢分解生成氧气的催化剂.
【实验拓展】B.
点评 本道题主要考查了实验室制取气体发生装置和收集装置的选择,发生装置主要取决于反应物的状态和反应条件,收集装置主要取决于气体的密度、溶水性、是否有毒、是否与水反应、是否与空气中的物质反应等.

| A. | 1:3:14 | B. | 1:6:14 | C. | 1:1:1 | D. | 1:2:1 |
| A. | 氮气>氧气>稀有气体>二氧化碳 | B. | 氧气>氮气>稀有气体>二氧化碳 | ||
| C. | 氮气>氧气>二氧化碳>稀有气体 | D. | 氧气>氮气>稀有气体>二氧化碳 |
| A. | 木炭在氧气中燃烧,有无色刺激性气味气体生成 | |
| B. | 红磷在氧气中剧烈燃烧,有黄色火焰,有大量白色气体生成 | |
| C. | 硫在氧气中燃烧发出明亮的蓝紫色火焰,产生有刺激性气味的气体 | |
| D. | 铁丝在空气中剧烈燃烧,放出大量的热,火星四射,有黑色熔融物溅落瓶底 |
| A. | 2002年我国有些小煤矿频频发生瓦斯爆炸事故,它属于化学变化 | |
| B. | 钢铁生锈后,铁锈质量比原来的钢铁大,不符合质量守恒定律 | |
| C. | 通电分解水的质量等于生成氢气和氧气的质量之和 | |
| D. | 水结冰后质量没有变化,它符合质量守恒定律 |
| A. | 海水显蓝色,湖水显绿色,所以水具有各种颜色 | |
| B. | 水是一种很好的溶剂,任何物质都可以很容易地溶解在水中 | |
| C. | 天然水、矿泉水都是纯净物 | |
| D. | 水是氧化物,是化合物,是纯净物 |