题目内容
将6.8g含杂质的锌粒,加入到盛有50.0g的稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),恰好完全反应后,称得烧杯内物质的总质量为56.6g.
试计算:
(1)生成氢气的质量?
(2)硫酸溶液里溶质的质量分数是多少(精确到0.1%)?
试计算:
(1)生成氢气的质量?
(2)硫酸溶液里溶质的质量分数是多少(精确到0.1%)?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)根据反应前后的质量差可以计算生成氢气的质量;
(2)根据氢气的质量可以计算硫酸溶液中溶质的质量,进一步可以计算硫酸溶液的质量分数.
(2)根据氢气的质量可以计算硫酸溶液中溶质的质量,进一步可以计算硫酸溶液的质量分数.
解答:解:
(1)根据质量守恒定律,生成氢气的质量为:6.8g+50.0g-56.6g=0.2g,
(2)设硫酸溶液中溶质的质量为x
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.2g
=
x=9.8g
硫酸溶液里溶质的质量分数是
×100%=19.6%
答案:
(1)生成氢气的质量为0.2g
(2)硫酸溶液里溶质的质量分数是19.6%
(1)根据质量守恒定律,生成氢气的质量为:6.8g+50.0g-56.6g=0.2g,
(2)设硫酸溶液中溶质的质量为x
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.2g
| 98 |
| 2 |
| x |
| 0.2g |
x=9.8g
硫酸溶液里溶质的质量分数是
| 9.8g |
| 50g |
答案:
(1)生成氢气的质量为0.2g
(2)硫酸溶液里溶质的质量分数是19.6%
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
次氯酸钠(NaClO)是日常生活中漂白液、消毒水的有效成分.次氯酸钠属于( )
| A、氧化物 | B、酸 | C、碱 | D、盐 |
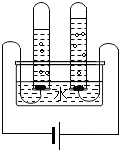 根据电解水的实验装置图完成下列问题:
根据电解水的实验装置图完成下列问题: