题目内容
二氧化碳的“捕捉”与“封存”是实现温室气体减排的重要途径之一.实际生产中,经常利用足量NaOH溶液来“捕捉”CO2,流程图如图(部分条件及物质未标出).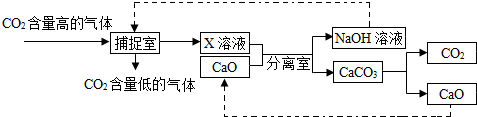
(1)分离室中进行的操作是 .
(2)“捕捉室”内发生反应的化学方程式为 .
(3)在整个捕捉过程中,可以循环利用的物质是 .
(4)捕捉到的二氧化碳是一种重要的资源,在高温高压下它与氨气(NH3)反应可以合成尿素[CO(NH2)2],同时生成水.该反应的化学方程式为: .

(1)分离室中进行的操作是
(2)“捕捉室”内发生反应的化学方程式为
(3)在整个捕捉过程中,可以循环利用的物质是
(4)捕捉到的二氧化碳是一种重要的资源,在高温高压下它与氨气(NH3)反应可以合成尿素[CO(NH2)2],同时生成水.该反应的化学方程式为:
考点:混合物的分离方法,二氧化碳的化学性质,书写化学方程式、文字表达式、电离方程式
专题:物质的分离和提纯
分析:(1)根据碳酸钙难溶于水进行解答;
(2)根据二氧化碳和氢氧化钠溶液反应生成碳酸钠和水进行解答;
(3)根据循环示意图分析循环使用的物质;
(4)根据二氧化碳在高温高压下它与氨气(NH3)反应可以合成尿素[CO(NH2)2],同时生成水,写出反应的化学方程式.
(2)根据二氧化碳和氢氧化钠溶液反应生成碳酸钠和水进行解答;
(3)根据循环示意图分析循环使用的物质;
(4)根据二氧化碳在高温高压下它与氨气(NH3)反应可以合成尿素[CO(NH2)2],同时生成水,写出反应的化学方程式.
解答:解:
(1)碳酸钙难溶于水,所以分离室中进行的操作是过滤;
(2)二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,反应的化学方程式为CO2+2NaOH=Na2CO3+H2O;
(3)在此反应中过程中,氧化钙和氢氧化钠能重复利用;
(4)二氧化碳在高温高压下它与氨气(NH3)反应可以合成尿素[CO(NH2)2],同时生成水,反应的化学方程式为:CO2+2NH3
CO(NH2)2 +H2O.
答案:
(1)过滤
(2)CO2+2NaOH=Na2CO3+H2O
(3)氧化钙和氢氧化钠
(4)CO2+2NH3
CO(NH2)2 +H2O.
(1)碳酸钙难溶于水,所以分离室中进行的操作是过滤;
(2)二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,反应的化学方程式为CO2+2NaOH=Na2CO3+H2O;
(3)在此反应中过程中,氧化钙和氢氧化钠能重复利用;
(4)二氧化碳在高温高压下它与氨气(NH3)反应可以合成尿素[CO(NH2)2],同时生成水,反应的化学方程式为:CO2+2NH3
| ||
答案:
(1)过滤
(2)CO2+2NaOH=Na2CO3+H2O
(3)氧化钙和氢氧化钠
(4)CO2+2NH3
| ||
点评:本题的难度不大,主要考查了碳及碳的化合物的知识.加强有关碳及其化合物的知识的学习,是解答本类题的基础.

练习册系列答案
相关题目