题目内容
氨气(NH3)是一种无色有刺激性气味的气体,极易溶于水,其水溶液称为氨水、显碱性.实验室里通常用加热固体氯化铵和固体氢氧化钙的混合物的方法制取氨气,其化学方程式 为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O.氨在化工生产中应用广泛,试回答下列问题:

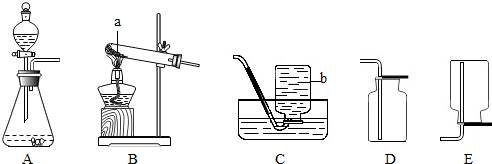
(1)实验室制氨气的发生装置是 ,
(2)收集氨气装置是 .一氧化氮气体难溶于水,在空气中容易发生下列反应2NO+O2═2NO2,则收集一氧化氮气体时不能用的装置是(填序号)
(3)“侯氏制碱法”中关键一步的反应原理可表示为:NH3+CO2+H2O+NaCl=NaHCO3+A,A是一种氮肥,其化学式为 .
(4)按图F作细铁丝在氧气中燃烧的实验,集气瓶中装有少量的水的目的是 ,该反应的化学方程式为 .
| ||

(1)实验室制氨气的发生装置是
(2)收集氨气装置是
(3)“侯氏制碱法”中关键一步的反应原理可表示为:NH3+CO2+H2O+NaCl=NaHCO3+A,A是一种氮肥,其化学式为
(4)按图F作细铁丝在氧气中燃烧的实验,集气瓶中装有少量的水的目的是
考点:常用气体的发生装置和收集装置与选取方法,氧气的化学性质,质量守恒定律及其应用,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)根据制取气体的反应物状态、反应条件选择发生装置;
(2)据气体的密度和溶解性选择收集装置;
(3)据反应前后原子的种类和数目不变求物质的化学式;
(4)据铁丝燃烧的注意事项和反应原理分析解答.
(2)据气体的密度和溶解性选择收集装置;
(3)据反应前后原子的种类和数目不变求物质的化学式;
(4)据铁丝燃烧的注意事项和反应原理分析解答.
解答:解:(1)实验室里通常用加热固体氯化铵和固体氢氧化钙的混合物的方法制取氨气,属于固体加热型,故选发生装置A;
(2)氨气极易溶于水,不能用排水法收集,其相对分子质量=14+1×3=17<29,密度比空气小,所以可用向下排空气法收集;一氧化氮气体难溶于水,在空气中容易发生下列反应2NO+O2═2NO2,一氧化氮的相对分子质量=14+16=30,密度比空气略大,但因为其可以和氧气反应,所以不能用向下排空气法收集;
(3)化学反应前后原子的种类和数目不变,NH3+CO2+H2O+NaCl=NaHCO3+A,反应物中有氮原子1个,氢原子5个,氧原子3个,碳原子1个,钠原子1个,氯原子1个,而生成物中有钠原子1个,氢原子1个,碳原子1个,氧原子3个,所以还需氢原子4个,氮原子1个,氯原子1个,而A是一种氮肥,所以其化学式为NH4Cl;
(4)做铁丝在氧气中燃烧实验时,要在集气瓶底部放一些水,防止燃烧后的高温生成物溅落炸裂瓶底;铁丝和氧气在点燃的条件下生成四氧化三铁,方程式是:故答案为:3Fe+2O2
Fe3O4;
(1)A;
(2)D;C;
(3)NH4Cl;
(4)防止燃烧后的高温生成物溅落炸裂瓶底;3Fe+2O2
Fe3O4.
(2)氨气极易溶于水,不能用排水法收集,其相对分子质量=14+1×3=17<29,密度比空气小,所以可用向下排空气法收集;一氧化氮气体难溶于水,在空气中容易发生下列反应2NO+O2═2NO2,一氧化氮的相对分子质量=14+16=30,密度比空气略大,但因为其可以和氧气反应,所以不能用向下排空气法收集;
(3)化学反应前后原子的种类和数目不变,NH3+CO2+H2O+NaCl=NaHCO3+A,反应物中有氮原子1个,氢原子5个,氧原子3个,碳原子1个,钠原子1个,氯原子1个,而生成物中有钠原子1个,氢原子1个,碳原子1个,氧原子3个,所以还需氢原子4个,氮原子1个,氯原子1个,而A是一种氮肥,所以其化学式为NH4Cl;
(4)做铁丝在氧气中燃烧实验时,要在集气瓶底部放一些水,防止燃烧后的高温生成物溅落炸裂瓶底;铁丝和氧气在点燃的条件下生成四氧化三铁,方程式是:故答案为:3Fe+2O2
| ||
(1)A;
(2)D;C;
(3)NH4Cl;
(4)防止燃烧后的高温生成物溅落炸裂瓶底;3Fe+2O2
| ||
点评:了解装置选取方法和铁丝燃烧实验、质量守恒定律的应用等知识即可顺利解答.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
 化学家Tim Richard首次发现分子结构图形酷似小狗的一种具有香味的有机物(如图所示),并命名为“小狗烯”(化学式为C26H26).下列有关小狗烯认识中不正确的是( )
化学家Tim Richard首次发现分子结构图形酷似小狗的一种具有香味的有机物(如图所示),并命名为“小狗烯”(化学式为C26H26).下列有关小狗烯认识中不正确的是( )| A、小狗烯属于有机化合物 |
| B、小狗烯由碳、氢两种元素组成 |
| C、小狗烯中碳、氢元素的原子个数比为 1:1 |
| D、每个小狗烯分子里含有13个氢分子 |
以下是四同学对生活中的现象进行探究后的结果的表述,其中错误的是( )
| A、“纯碱”其实不是碱,属于盐类 |
| B、可用纯碱代替洗涤剂洗涤餐具表面的油污 |
| C、用纯碱可去除面团发酵产生的酸 |
| D、用加水溶解的方法检验纯碱中是否混入了盐 |
 ,则该元素的原子核外有
,则该元素的原子核外有