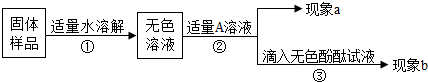
题目内容
 酸、碱、盐是几类有广泛用途的重要化合物.
酸、碱、盐是几类有广泛用途的重要化合物.
(1)酸和碱在组成和性质方面有很多共同的特点,请任写出其中的一条.
(2)氢氧化钙是一种常见的碱,列举其在生产、生活中的一种用途.
(3)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如右图)的溶液,他们对此产生了兴趣.
提出问题:这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种.为了确定该药品,他们首先进行了理论分析:
①小明根据标签上的组成元素认为一定不可能是______(提示:只有其中一种).
②小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是:
设计实验:为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验.
| 实验操作 | 实验现象 |
| 取少量样品于试管中,慢慢滴加BaCl2溶液 | 出现白色沉淀 |
| 静置一段时间后,倾去上层清液,向沉淀中滴加稀盐酸 | 白色沉淀全部溶解,并产生大量气泡 |
实验反思:④小强认为上述设计实验还可简化,也能达到目的.小强的实验操作是:
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
解:(1)酸、碱在组成和性质上的相似点有:组成中都含有氢元素,都能使指示剂变色,有腐蚀性等;
(2)氢氧化钙显碱性,且比较廉价,农业上常用来改良酸性土壤,并可于硫酸铜反应用来配制农药波尔多液,还是一种常用的建筑材料等;
(3)①该标签显示该物质中一定含有钠元素、氧元素,而氯化钠不含有氧元素,所以从组成上可以判断该物质一定不是氯化钠;
②碳酸氢钠和硝酸钠的化学式中钠元素的右下角数字是1,而不是2,所以不可能是碳酸氢钠和硝酸钠;
③硫酸钠、碳酸钠可与氯化钡溶液反应分别生成硫酸钡、碳酸钡沉淀,但硫酸钡沉淀与稀盐酸不反应,碳酸钡沉淀可与稀盐酸反应生成氯化钡、水和二氧化碳,所以根据向沉淀中加入稀盐酸,白色沉淀全部溶解,并产生大量气泡可知该瓶溶液是碳酸钠溶液,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,反应方程式是BaCl2 +Na2CO3═BaCO3↓+2NaCl;
④碳酸钠可与盐酸反应生成二氧化碳,而硫酸钠与盐酸不反应,所以可取样品滴加稀盐酸观察是否有气泡生成进行判断,这样操作步骤更简洁;
(4)设反应后生成氯化钠的质量为 x
HCl+NaOH═NaCl+H2 O
36.5 58.5
73g×20% x
 =
=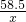
x=23.4 g
反应后所得溶液的质量分数为:
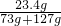 ×100%═11.7%
×100%═11.7%
故答案为:(1)组成上都含有氢元素(或都能使指示剂变色或都有腐蚀性等);
(2)改良酸性土壤(或粉刷墙壁、配制农药波尔多液等);
(3)①氯化钠;
②这两种物质的化学式中Na元素的右下角不会有2;
③碳酸钠溶液; BaCl2 +Na2CO3═BaCO3↓+2NaCl;
④取少量无色溶液样品于试管中,慢慢滴加稀盐酸;
(4)答:反应后所得溶液的质量分数为11.7%.
分析:(1)根据酸、碱组成中都含有氢元素,都能使指示剂变色,有腐蚀性进行回答;
(2)氢氧化钙显碱性,且比较廉价,农业上常用来改良酸性土壤,并可用来配制农药波尔多液等;
(3)①该标签显示该物质中一定含有钠元素、氧元素,而氯化钠不含有氧元素,据此判断;
②碳酸氢钠和硝酸钠的化学式中钠元素的右下角数字是1,而不是2;
③硫酸钠、碳酸钠可与氯化钡溶液反应分别生成硫酸钡、碳酸钡沉淀,不过硫酸钡沉淀与稀盐酸不反应,碳酸钡沉淀可与稀盐酸反应生成氯化钡、水和二氧化碳,据此推测该瓶溶液,并书写反应方程式;
④据碳酸钠可与盐酸反应生成二氧化碳,而硫酸钠与盐酸不反应设计实验进行验证步骤更简洁;
(4)据溶质的质量=溶液的质量×溶质的质量分数可计算出反应的盐酸溶质的质量,并结合方程式计算出氯化钠的质量,进而计算溶液的溶质质量分数.
点评:本题考查知识较为全面,既考查了酸、碱、盐的性质,还考查了学生依据所学知识进行计算、分析解答问题的能力,是一道不错的题目.
(2)氢氧化钙显碱性,且比较廉价,农业上常用来改良酸性土壤,并可于硫酸铜反应用来配制农药波尔多液,还是一种常用的建筑材料等;
(3)①该标签显示该物质中一定含有钠元素、氧元素,而氯化钠不含有氧元素,所以从组成上可以判断该物质一定不是氯化钠;
②碳酸氢钠和硝酸钠的化学式中钠元素的右下角数字是1,而不是2,所以不可能是碳酸氢钠和硝酸钠;
③硫酸钠、碳酸钠可与氯化钡溶液反应分别生成硫酸钡、碳酸钡沉淀,但硫酸钡沉淀与稀盐酸不反应,碳酸钡沉淀可与稀盐酸反应生成氯化钡、水和二氧化碳,所以根据向沉淀中加入稀盐酸,白色沉淀全部溶解,并产生大量气泡可知该瓶溶液是碳酸钠溶液,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,反应方程式是BaCl2 +Na2CO3═BaCO3↓+2NaCl;
④碳酸钠可与盐酸反应生成二氧化碳,而硫酸钠与盐酸不反应,所以可取样品滴加稀盐酸观察是否有气泡生成进行判断,这样操作步骤更简洁;
(4)设反应后生成氯化钠的质量为 x
HCl+NaOH═NaCl+H2 O
36.5 58.5
73g×20% x
 =
=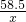
x=23.4 g
反应后所得溶液的质量分数为:
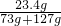 ×100%═11.7%
×100%═11.7% 故答案为:(1)组成上都含有氢元素(或都能使指示剂变色或都有腐蚀性等);
(2)改良酸性土壤(或粉刷墙壁、配制农药波尔多液等);
(3)①氯化钠;
②这两种物质的化学式中Na元素的右下角不会有2;
③碳酸钠溶液; BaCl2 +Na2CO3═BaCO3↓+2NaCl;
④取少量无色溶液样品于试管中,慢慢滴加稀盐酸;
(4)答:反应后所得溶液的质量分数为11.7%.
分析:(1)根据酸、碱组成中都含有氢元素,都能使指示剂变色,有腐蚀性进行回答;
(2)氢氧化钙显碱性,且比较廉价,农业上常用来改良酸性土壤,并可用来配制农药波尔多液等;
(3)①该标签显示该物质中一定含有钠元素、氧元素,而氯化钠不含有氧元素,据此判断;
②碳酸氢钠和硝酸钠的化学式中钠元素的右下角数字是1,而不是2;
③硫酸钠、碳酸钠可与氯化钡溶液反应分别生成硫酸钡、碳酸钡沉淀,不过硫酸钡沉淀与稀盐酸不反应,碳酸钡沉淀可与稀盐酸反应生成氯化钡、水和二氧化碳,据此推测该瓶溶液,并书写反应方程式;
④据碳酸钠可与盐酸反应生成二氧化碳,而硫酸钠与盐酸不反应设计实验进行验证步骤更简洁;
(4)据溶质的质量=溶液的质量×溶质的质量分数可计算出反应的盐酸溶质的质量,并结合方程式计算出氯化钠的质量,进而计算溶液的溶质质量分数.
点评:本题考查知识较为全面,既考查了酸、碱、盐的性质,还考查了学生依据所学知识进行计算、分析解答问题的能力,是一道不错的题目.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为 g.稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因.
(3)熟石灰是一种重要的碱,在工农生产和日常生活中都有十分广泛的应用.工业上首先是用大理石(主要成分碳酸钙)高温煅烧来制取生石灰,然后再用生石灰与水反应来制取熟石灰.请你写出有关反应的化学方程式.
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是 .
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据图中部分物质的溶解性表(20℃)所提供的信息,将下表填写完整.
(5)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据图中部分物质的溶解性表(20℃)所提供的信息,将下表填写完整.
| 阳离子\阴离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的 充分反应后过滤 |
有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 该样品中含有氢氧化钠 |
 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.