题目内容
12.生活中处处有化学,下列说法正确的是( )| A. | 纸张不可燃 | B. | 乙醇汽油属于混合物 | ||
| C. | 活性炭可以将硬水软化 | D. | 可用打火机检查天然气是否泄漏 |
分析 A.根据纸张的性质来分析;
B.根据混合物是由不同物质组成的物质考虑;
C.活性炭具有吸附性,能吸附异味和色素,据此进行分析判断;
D.运用天然气遇火可能会爆炸解答.
解答 解:A.纸张具有可燃性,故错误;
B.乙醇汽油中含有乙醇和汽油,属于混合物,故正确;
C.活性炭具有吸附性,能吸附异味和色素,不能降低可溶性钙镁化合物的含量,向水中加入活性炭不能将硬水进行软化,故错误;
D.天然气遇火可能会爆炸,故错误.
故选B.
点评 化学与我们的生活息息相关,与生产、生活相关的知识是中考考查的热点之一,灵活运用所学知识是正确解答本题的关键.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 聚氯乙烯薄膜无毒,故可用于制食品包装袋 | |
| B. | 食用加碘食盐可预防甲状腺肿大 | |
| C. | 人体所需的能量全部由糖类和油脂提供,故不需摄入蛋白质 | |
| D. | 微量元素对人体健康起着重要作用,故摄入量越多越好 |
3.某实验小组的同学想用碳酸钠溶液与饱和石灰水反应来制取少量氢氧化钠.
(1)该复分解反应能发生的理由是有沉淀生成,符合复分解反应的条件.
(2)有人提出:实验时没有注意药品的用量,所得到的氢氧化钠溶液可能不纯.
猜测一:只含NaOH;
猜测二:含有NaOH和Na2CO3;
你的猜想是:Na2C03和Ca(OH)2.
(3)为了验证你的猜想,请你选择适当的试剂,完成实验设计方案并填写下列表格.
(1)该复分解反应能发生的理由是有沉淀生成,符合复分解反应的条件.
(2)有人提出:实验时没有注意药品的用量,所得到的氢氧化钠溶液可能不纯.
猜测一:只含NaOH;
猜测二:含有NaOH和Na2CO3;
你的猜想是:Na2C03和Ca(OH)2.
(3)为了验证你的猜想,请你选择适当的试剂,完成实验设计方案并填写下列表格.
| 实验步骤 | 预期现象 | 结论 |
| 取少量反应后得到的溶液于试管中,滴入碳酸钠溶液. | 无明显现象 | 你的猜想不正确 |
7.某学习小组对粗盐中杂质(难溶性和可溶性)的去除展开相关探究.
(1)粗盐中难溶性杂质去除的实验步骤为①溶解,②过滤,③蒸发(写操作名称),④计算产率.
(2)步骤②中需要用到的玻璃仪器有:玻璃棒、烧杯、漏斗(写仪器名称),其中玻璃棒的作用是引流.
(3)【提出猜想】
甲同学:该粗盐中含有难溶性杂质外,是否还含有可溶性杂质?
(4)【查阅资料】
①粗盐中可能含有镁盐(Mg2+)和硫酸盐(SO42-)等可溶性杂质.
②一些物质的溶解性表
说明:“溶”表示该物质可溶于水,“不”表示该物质不溶于水.
③Mg(OH)2为白色物质,不溶于氢氧化钠溶液;BaSO4为白色物质,不溶于盐酸;
MgCO3,BaCO3为白色物质都能溶于盐酸.
(5)【实验设计】
①取少量除去难溶性杂质后的盐,溶于水配成溶液.
②取少量所配溶液于试管中,滴加氢氧化钠溶液,产生白色沉淀,继续滴加氢氧化钠溶液,沉淀不溶,说明该盐含有可溶性的镁盐.
③另取少量所配溶液于试管中,滴加氯化钡溶液,产生白色沉淀,再加稀盐酸,沉淀不溶,说明该盐含有可溶性的硫酸盐.
(6)【实验结论】该盐含有可溶性杂质硫酸镁.
(7)【实验拓展】以下为乙同学设计的去除食盐中可溶性杂质的试验流程:
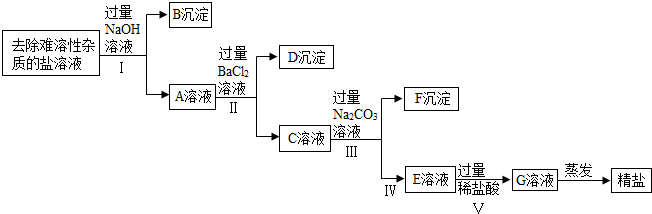
①该实验过程中,除杂试剂都要过量,原因是将杂质完全除去.
②过量Na2CO3溶液用来除Ba2+离子(填离子序号).
(1)粗盐中难溶性杂质去除的实验步骤为①溶解,②过滤,③蒸发(写操作名称),④计算产率.
(2)步骤②中需要用到的玻璃仪器有:玻璃棒、烧杯、漏斗(写仪器名称),其中玻璃棒的作用是引流.
(3)【提出猜想】
甲同学:该粗盐中含有难溶性杂质外,是否还含有可溶性杂质?
(4)【查阅资料】
①粗盐中可能含有镁盐(Mg2+)和硫酸盐(SO42-)等可溶性杂质.
②一些物质的溶解性表
| 阳离子 阴离子 | OH- | CL- | SO${\;}_{4}^{2-}$ | CO${\;}_{3}^{2-}$ |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 不 |
③Mg(OH)2为白色物质,不溶于氢氧化钠溶液;BaSO4为白色物质,不溶于盐酸;
MgCO3,BaCO3为白色物质都能溶于盐酸.
(5)【实验设计】
①取少量除去难溶性杂质后的盐,溶于水配成溶液.
②取少量所配溶液于试管中,滴加氢氧化钠溶液,产生白色沉淀,继续滴加氢氧化钠溶液,沉淀不溶,说明该盐含有可溶性的镁盐.
③另取少量所配溶液于试管中,滴加氯化钡溶液,产生白色沉淀,再加稀盐酸,沉淀不溶,说明该盐含有可溶性的硫酸盐.
(6)【实验结论】该盐含有可溶性杂质硫酸镁.
(7)【实验拓展】以下为乙同学设计的去除食盐中可溶性杂质的试验流程:

①该实验过程中,除杂试剂都要过量,原因是将杂质完全除去.
②过量Na2CO3溶液用来除Ba2+离子(填离子序号).
17.下列可以作为溶质的是( )
| A. | 只有固体 | B. | 只有液体 | ||
| C. | 只有气体 | D. | 固体或液体或气体 |
1.根据常见酸碱盐的溶解性表的一部分信息填空.
表中物质都是由其对应行与列所表示的两种“成分”组成的,如物质④所在行为“Ca2+”,所在列为“NO3-”,则其化学式为Ca(NO3)2,说出物质③的一种用途是用于玻璃、造纸、纺织和洗涤剂的生产等,写出选用表中合适的两种“成分”组成物质来制备物质①的化学方程式Ba(OH)2+Na2SO4=BaSO4↓+2NaOH(合理即可).
| OH- | NO3- | SO42- | CO32- | |
| Ba2+ | 溶 | 溶 | 不① | 不 |
| Na+ | 溶 | 溶② | 溶 | 溶③ |
| Ca2+ | 溶 | 溶④ | 微 | 不 |
2.判断下列化学方程式中,属于分解反应的是( )
| A. | H2SO4+2NaOH═Na2SO4+2H2O | B. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | D. | Fe+CuSO4═FeSO4+Cu |