题目内容
1.一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比仍为饱和溶液(选填“仍为饱和溶液”或“变为不饱和溶液”),溶质的质量分数不变(选填“不变”、“变大”或“变小”).分析 一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),据此结合饱和溶液的特征、溶质质量分数的概念,进行分析解答.
解答 解:一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,不能继续溶解溶质,则剩余溶液与原溶液相比,仍为饱和溶液.
溶质的质量减少,溶剂的质量不变,则溶质的质量分数不变.
故答案为:仍为饱和溶液;不变.
点评 本题难度不大,掌握饱和溶液析出晶体后溶液组成的变化是正确解答本题的关键.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
11.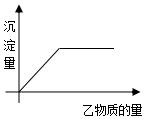 向甲物质中加入(或通入)乙物质,生成的沉淀量与所用的乙物质的量关系如图,则表中不符合条件的一组是( )
向甲物质中加入(或通入)乙物质,生成的沉淀量与所用的乙物质的量关系如图,则表中不符合条件的一组是( )
 向甲物质中加入(或通入)乙物质,生成的沉淀量与所用的乙物质的量关系如图,则表中不符合条件的一组是( )
向甲物质中加入(或通入)乙物质,生成的沉淀量与所用的乙物质的量关系如图,则表中不符合条件的一组是( )| 组别 | 甲 | 乙 |
| A | FeCl3溶液 | NaOH溶液 |
| B | NaOH溶液 | CO2气体 |
| C | CuSO4溶液 | BaCl2 |
| D | 一定量海水 | AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
16.某小组以稀硫酸与氢氧化钠溶液是否能发生反应为课题进行研究.同学向烧杯中的氢氧化钠溶液加入稀硫酸,一会发现忘记滴加指示剂,因此他们停止滴加稀硫酸,并对烧杯内稀硫酸和氢氧化钠溶液是否发生反应进行探究.
(1)小组同学设计了以下实验方案:
(2)写出该反应的化学方程式:2NaOH+H2SO4═Na2SO4+2H2O
(3)同学们一致讨论认为,不用上述方法,用其他试剂也可以证明稀硫酸与氢氧化钠溶液能发生反应,于是分成甲乙两组实验.
甲组实验:探究CuSO4溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应.
操作及现象:向氢氧化钠溶液中加入足量稀硫酸时无明显现象,再滴加CuSO4溶液时没有出现沉淀.
结论:通过以上实验,你认为用CuSO4溶液可以(填可以或不可以)证明稀硫酸与氢氧化钠溶液能发生反应.
乙组实验:探究BaCl2溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应.
操作及现象:向稀硫酸中加入足量氢氧化钠溶液时无明显现象,再滴加BaCl2溶液时出现白色沉淀.
结论:通过以上实验,你认为用BaCl2溶液不可以(填可以或不可以)证明稀硫酸与氢氧化钠溶液能发生反应.理由是:稀硫酸、硫酸钠都会电离出硫酸根离子,硫酸根离子都会与钡离子生成硫酸钡沉淀.
(1)小组同学设计了以下实验方案:
| 实验步骤 | 实验现象 | 实验结论 |
| 在白瓷板上放一小片pH试纸,用玻璃棒蘸取少量反应后的溶液滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,读溶液的pH | pH<7 (填“>”、“=”或“<”) | 稀硫酸与氢氧化钠溶液发生了反应,且稀硫酸过量了. |
(3)同学们一致讨论认为,不用上述方法,用其他试剂也可以证明稀硫酸与氢氧化钠溶液能发生反应,于是分成甲乙两组实验.
甲组实验:探究CuSO4溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应.
操作及现象:向氢氧化钠溶液中加入足量稀硫酸时无明显现象,再滴加CuSO4溶液时没有出现沉淀.
结论:通过以上实验,你认为用CuSO4溶液可以(填可以或不可以)证明稀硫酸与氢氧化钠溶液能发生反应.
乙组实验:探究BaCl2溶液是否可以证明稀硫酸与氢氧化钠溶液发生反应.
操作及现象:向稀硫酸中加入足量氢氧化钠溶液时无明显现象,再滴加BaCl2溶液时出现白色沉淀.
结论:通过以上实验,你认为用BaCl2溶液不可以(填可以或不可以)证明稀硫酸与氢氧化钠溶液能发生反应.理由是:稀硫酸、硫酸钠都会电离出硫酸根离子,硫酸根离子都会与钡离子生成硫酸钡沉淀.
11.为了测定某铜锌合金(即铜锌混合物)中锌的质量分数,某同学利用该合金与稀硫酸的反应,进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):
(1)试计算该铜锌合金中锌的质量分数.
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为1:4时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应.
| 第一次 | 第二次 | 第三次 | |
| 所取合金的质量/g | 25 | 25 | 50 |
| 所用稀硫酸的质量/g | 120 | 160 | 100 |
| 生产氢气的质量/g | 0.4 | 0.4 | 0.4 |
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为1:4时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应.

 如图是小柯同学在复习科学时,构建酸通性的“手掌图”.
如图是小柯同学在复习科学时,构建酸通性的“手掌图”.