题目内容
8.如图是配制50g溶质质量分数为5%的NaCl溶液的操作示意图
(1)(A)处有一个明显的错误是瓶塞没有倒放;
(2)(D)处量筒的规格应选用50mL(选50mL或100mL);
(3)E处玻璃棒的作用是搅拌,加速固体溶解.
(4)如果(B)处称量时物体和砝码的位置放反了(1g以下用游码),而其他操作步骤都正确,则实际配得的NaCl溶液的溶质质量分数偏小(填偏大或偏小).
分析 (1)根据药品取放的注意事项考虑本题;
(2)根据量筒的选取方法考虑;
(3)根据玻璃棒的作用考虑;
(4)根据左物右码和左码右物的区别考虑.
解答 解:(1)取放药品时,瓶塞要倒放在桌面上,正放会腐蚀桌面和污染药品;
(2)由题意可知,配制50g溶质质量分数为5%的NaCl溶液,需要氯化钠的质量为50g×5%=25.g,需要是的质量的为50g-25.5g=47.5g,即水的体积为47.5mL,所以选取50mL量筒;
(3)固体溶解时用玻璃棒搅拌,加速固体溶解;
(4)由左盘的质量=右盘的质量+游码的质量可知:砝码质量=物体质量+游码的质量,所以物体质量=砝码质量-游码质量,即:物体质量=2.0 g-0.5 g=1.5g.质量分数为:$\frac{1.5g}{1.5g+47.5g}$×100%=3.1%<5%.,所以则实际配得的NaCl溶液的溶质质量分数偏小.
故答案为:(1)瓶塞没有倒放;(2)50mL;(3)搅拌,加速固体溶解;(4)偏小.
点评 在计算有关天平的题目时,要谨记左盘的质量═右盘的质量+游码的质量,由此列等式计算,不管是左物右码还是左码右物,都可以算.

练习册系列答案
相关题目
13.在①金刚石、②石墨、③二氧化碳、④二氧化硫、⑤天然气、⑥氢气灯物质中,选择填空:
| 固体俗称“干冰”的物质 | 硬度最大的物质 | 有刺激性气味的气体 | 最理想的清洁燃料 | 铅笔芯的主要成分 | 属于化石燃料的物质 |
20.碳在氧气中燃烧,下列说法符合质量守恒定律的是( )
| A. | 3g碳与8g氧气完全化合,可生成11g二氧化碳 | |
| B. | 2g碳与4g氧气完全化合,可生成22g二氧化碳 | |
| C. | 4g碳与5g氧气完全化合,可生成9g二氧化碳 | |
| D. | 5g碳与9g氧气完全化合,可生成14g二氧化碳 |
18. 如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是( )
如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是( )
 如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是( )
如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是( )| A. | 固体中氧元素的质量 | B. | 生成O2的质量 | ||
| C. | 固体中二氧化锰的质量 | D. | 生产氯化钾的质量 |
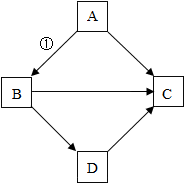 物质之间的相互转化是科学中的重要知识.某同学在复习物质性质时,绘制了如下框图.框图中“→”表示物质之间可以向箭头所指方向一步转化.根据框图,回答下列问题.
物质之间的相互转化是科学中的重要知识.某同学在复习物质性质时,绘制了如下框图.框图中“→”表示物质之间可以向箭头所指方向一步转化.根据框图,回答下列问题.