题目内容
16.如图是1~18号元素原子最外层电子数与原子核电荷数的关系图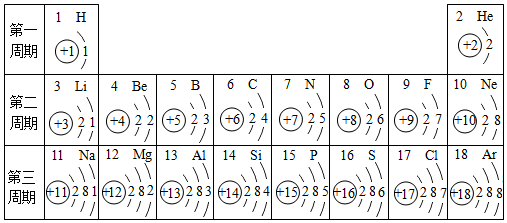
试回答:
(1)一个水分子共有3个原子核,10个质子.
(2)一个Mg2+共有10个电子.Cl-的最外层电子数和Ar原子的最外层电子数相同.
(3)通过上图你能发现哪些规律?请写出其中一个:随着核电荷数的递增,最外层电子数呈周期性变化.
分析 (1)由图中1~18号元素原子最外层电子数与原子核电荷数的关系图可知:氢元素、氧元素的质子数;
(2)一个Mg2+是失去2个电子而带的正电荷,故可知其离子核外电子数;Cl-是得到1个电子而带的负电荷,故可知其离子最外层电子数;
(3)通过对该图的分析,总结归纳规律.
解答 解:(1)根据“核内质子数=核外电子数=核电荷数”,由图中1~18号元素原子最外层电子数与原子核电荷数的关系图可知:氢元素、氧元素的质子数分别为:1、8;又因为1个水分子由2个氢原子和1个氧原子构成;故一个水分子共有3个原子核,1×2+8=10个质子;
(2)一个Mg2+是失去2个电子而带的正电荷,故可知其离子核外电子数为:12-2=10个;Cl-是得到1个电子而带的负电荷,故可知其离子最外层电子数为:7+1=8,故与Ar、Ne原子的最外层电子数相同;
(3)通过对该图的分析,总结归纳规律:随着核电荷数的递增,最外层电子数呈周期性变化.
故答为:(1)3;10;(2)10;Ar;(3)随着核电荷数的递增,最外层电子数呈周期性变化.
点评 了解原子的定义和构成:原子由原子核和核外电子构成,其中原子核由质子和中子构成的;了解核外电子在化学反应中的作用.

练习册系列答案
相关题目
6.氧气是空气的主要成分之一,有关氧气说法错误的是( )
| A. | 氧气属于单质 | |
| B. | 用加热高锰酸钾的方法可以制取氧气 | |
| C. | 鱼类能在水中生活,证明氧气易溶于水 | |
| D. | 铁丝能在氧气中燃烧,火星四射,产生黑色固体 |
4.镁带在空气中充分燃烧后,会产生一些灰白色固体(以下简称A样品).为了弄清A样品的成分,小明、小亮、小红三位同学分别进行了如下实验探究:
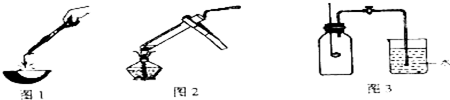
【实验与探究】
小明:(见图1)用分析天平称取三份经砂纸打磨的镁带,分别在空气中充分燃烧,待燃烧产物冷却后,称重.相关数据见下表
分析:2.4024g Mg在足量纯氧中燃烧,理论上应生成4.004g MgO.结合表中数据,可推断A样品中,除MgO外存在(填“存在”或“不存在”)其他物质.
小亮:(见图2)取少量A样品于试管中,加少量水,出现白色沉淀,微热,发现有使湿润的红色石蕊试纸变蓝的气体生成,则此气体是NH3 (填化学式)继续加足量水,仔细观察发现试管中除白色沉淀外,还有极少量的黑色不溶物.结合空气组成,小亮推测A样品应有MgO、Mg3N2 、C(填化学式)三种物质.
小红:(见图3)先用足量的红磷做燃烧实验,冷却后,打开止水阀,结果发现烧杯中的水倒流入广口瓶中,倒流入的水的体积与广口瓶容积之比约为$\frac{1}{5}$,此时瓶中剩余气体的主要成分为N2(填化学式);关闭止水阀,取出连带橡皮塞的燃烧匙,迅速塞上备用橡皮塞,向燃烧匙中加入镁带并引燃,取下备用橡皮塞,将燃烧匙迅速插入瓶中,并将橡皮塞塞紧,发现镁带继续燃烧,产生黄色火焰,冷却后,打开止水阀,结果发现烧杯中的水依然倒流入广口瓶中.小红的结论是镁带能在氮气中燃烧.
【交流与思考】
(1)小明的探究实验中,假如镁带未用砂纸打磨,则会不会给他的分析结果带来影响?请简述理由.
(2)综合上述探究,尝试写出镁条在空气中燃烧的有关化学方程式.
(3)若m克镁在空气中完全燃烧,共得到n克固体,则消耗O2的质量为(n-m)克.(计算时空气中的二氧化碳忽略不计)

【实验与探究】
小明:(见图1)用分析天平称取三份经砂纸打磨的镁带,分别在空气中充分燃烧,待燃烧产物冷却后,称重.相关数据见下表
| 反应前镁带的质量 | 反应的固体产物的质量 | |
| 第一次 | 2.4046g | 3.8854g |
| 第二次 | 2.4024g | 3.8839g |
| 第三次 | 2.4063g | 3.8857g |
小亮:(见图2)取少量A样品于试管中,加少量水,出现白色沉淀,微热,发现有使湿润的红色石蕊试纸变蓝的气体生成,则此气体是NH3 (填化学式)继续加足量水,仔细观察发现试管中除白色沉淀外,还有极少量的黑色不溶物.结合空气组成,小亮推测A样品应有MgO、Mg3N2 、C(填化学式)三种物质.
小红:(见图3)先用足量的红磷做燃烧实验,冷却后,打开止水阀,结果发现烧杯中的水倒流入广口瓶中,倒流入的水的体积与广口瓶容积之比约为$\frac{1}{5}$,此时瓶中剩余气体的主要成分为N2(填化学式);关闭止水阀,取出连带橡皮塞的燃烧匙,迅速塞上备用橡皮塞,向燃烧匙中加入镁带并引燃,取下备用橡皮塞,将燃烧匙迅速插入瓶中,并将橡皮塞塞紧,发现镁带继续燃烧,产生黄色火焰,冷却后,打开止水阀,结果发现烧杯中的水依然倒流入广口瓶中.小红的结论是镁带能在氮气中燃烧.
【交流与思考】
(1)小明的探究实验中,假如镁带未用砂纸打磨,则会不会给他的分析结果带来影响?请简述理由.
(2)综合上述探究,尝试写出镁条在空气中燃烧的有关化学方程式.
(3)若m克镁在空气中完全燃烧,共得到n克固体,则消耗O2的质量为(n-m)克.(计算时空气中的二氧化碳忽略不计)
1.除去下列物质中的杂质(括号内为杂质),所选试剂及操作方法均正确的一组是( )
| 选项 | 待提纯的物质 | 所选试剂及操作方法 |
| A | 氯化钠(碳酸钙) | 水、溶解、过滤、蒸发结晶 |
| B | 碳粉(铁) | 在空气中灼烧 |
| C | 氯化钾(氯酸钾) | 加入二氧化锰加热 |
| D | 硫酸铜(铁) | 加适量的水、过滤、蒸发结晶 |
| A. | A | B. | B | C. | C | D. | D |
8.请根据如表回答有关问题
(1)写出纯碱的化学式Na2CO3
(2)表中物质属于氧化物的是② 属于盐的是④
(3)表中四种物质放入相等的水中,所得的溶液中PH最小的是①
(4)你认为CH3C00H(其性质类似于盐酸)可以与表中②③④ 物质发生化学反应
(5)写出③和④发生反应的化学方程式Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
(1)写出纯碱的化学式Na2CO3
(2)表中物质属于氧化物的是② 属于盐的是④
(3)表中四种物质放入相等的水中,所得的溶液中PH最小的是①
(4)你认为CH3C00H(其性质类似于盐酸)可以与表中②③④ 物质发生化学反应
(5)写出③和④发生反应的化学方程式Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
| 序号 | ① | ② | ③ | ④ |
| 物质 | 醋酸 | 生石灰 | 熟石灰 | 纯碱 |
| 化学式 | CH3COOH | CaO | Ca(OH)2 | Na2CO3 |
