题目内容
10.碳及其化合物在生产和生产中具有重要的作用.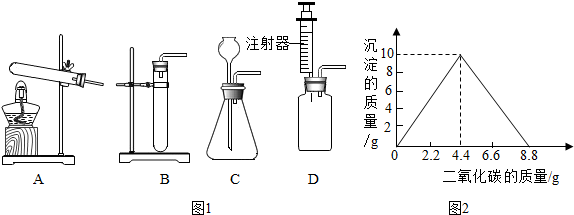
(1)我国古代的一些水墨书画作品可以保存长时间的原因是在常温下,碳的化学性质稳定.
(2)一氧化碳的用途十分广泛,其主要的用途是可以作为气体燃料,在使用时要注意的问题是防止一氧化碳中毒.
(3)老师提出用碳酸钠粉末与盐酸制取二氧化碳,其反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.为了完成该实验,有四位同学组装了图1发生装置,你认为最合适的一套装置是D(填序号),该装置的最大优点是能控制反应速率.用pH试纸测定反应后溶液的酸碱度的方法是取待测液体少许滴在pH试纸上,将试纸显示颜色与标准比色卡对照,读出pH值.
(4)甲烷也是造成温室效应的一种气体,写出甲烷燃烧的化学方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
(5)某实验小组在一定量的石灰水中通入CO2,产生沉淀的质量与通CO2质量的关系如图2所示.已知反应:CaCO3+H2O+CO2═Ca(HCO3)2,Ca(HCO3)2易溶于水.
①请描述实验过程中可观察到的现象.
②请计算通CO2气体前石灰水中溶质的质量.(请写出计算过程)
分析 (1)根据碳的化学性质稳定进行分析;
(2)根据一氧化碳有毒进行分析;
(3)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,该反应的反应物是固体和液体,反应条件是常温,反应速率快,以及pH试纸测定溶液pH值的方法进行分析;
(4)根据甲烷和氧气在点燃的条件下生成水和二氧化碳进行分析;
(5)①根据二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水,碳酸钙、水和二氧化碳反应能生成碳酸氢钙;
②根据产生沉淀的质量可以计算通CO2气体前石灰水中溶质的质量.
解答 解:(1)我国古代的一些水墨书画作品可以保存长时间的原因是:在常温下,碳的化学性质稳定;
(2)一氧化碳的用途十分广泛,其主要的用途是可以作为气体燃料,在使用时要注意的问题是防止一氧化碳中毒;
(3)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,该反应的反应物是固体和液体,反应条件是常温,反应速率快,所以最合适的一套装置是D,该装置的最大优点是:能控制反应速率,pH试纸测定溶液pH值的方法是:取待测液体少许滴在pH试纸上,将试纸显示颜色与标准比色卡对照,读出pH值;
(4)甲烷和氧气在点燃的条件下生成水和二氧化碳,化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;
(5)①实验过程中可观察到的现象为:先出现白色沉淀,接着沉淀慢慢溶解;
②设通CO2气体前石灰水中溶质的质量为x,产生10g碳酸钙沉淀时反应的二氧化碳的质量为y,
Ca(OH)2+CO2═CaCO3↓+H20,
74 44 100
x y 10g
$\frac{74}{x}$=$\frac{44}{y}$=$\frac{100}{10g}$
x=7.4g
y=4.4g
答:通CO2气体前石灰水中溶质的质量为7.4g.
故答案为:(1)在常温下,碳的化学性质稳定;
(2)防止一氧化碳中毒;
(3)Na2CO3+2HCl=2NaCl+H2O+CO2↑,D,能控制反应速率,取待测液体少许滴在pH试纸上,将试纸显示颜色与标准比色卡对照,读出pH值;
(4)CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;
(5)①先出现白色沉淀,接着沉淀慢慢溶解;
②通CO2气体前石灰水中溶质的质量为7.4g.
点评 本题主要考查了和碳有关的化学知识,难度不大,知识量大,需要在平时加强记忆即可完成.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. |  收集氢气 | |
| B. |  验证二氧化碳的密度大于空气 | |
| C. |  配制20%的溶液 | |
| D. |  向左推动针筒活塞可检验该装置的气密性 |
| A. |  常温下,稀释KOH溶液 | |
| B. |  甲烷和过量的氧气在密闭容器中完全反应 | |
| C. | 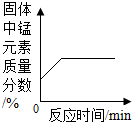 加热一定质量高锰酸钾固体 | |
| D. |  在装有稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量 |
| A. | 分子一定由原子构成;原子核一定由质子和中子构成 | |
| B. | 碱中一定含有氢元素;有机物中一定含有碳元素 | |
| C. | 纯净物一定由同种分子构成;生成盐和水的反应一定是中和反应 | |
| D. | 冷却热饱和溶液一定会有晶体析出;溶液中的溶剂一定是水 |
| A. | 湿衣服晾干-分子在不断运动 | |
| B. | 铁制品在潮湿的空气中容易生锈-是因为铁能与氧气、水蒸气发生缓慢氧化 | |
| C. | 铝制品具有抗腐蚀性-铝的化学性质不活泼 | |
| D. | 洗洁精能去除油污-是因为洗洁精具有乳化作用 |
| A. |  检验CO2是否集满 | B. |  加热液体 | ||
| C. |  滴加液体 | D. |  称量NaOH固体质量 |
 探究影响化学反应速率的因素
探究影响化学反应速率的因素(1)发现和提出问题
镁在空气中能够剧烈燃烧,铁丝在氧气中能够剧烈燃烧,而真金不怕火炼,这说明决定物质之间能否发生反应以及反应速率的内因是反应物本身的性质.
蜡烛在氧气中燃烧比在空气中燃烧剧烈,这一事例中影响化学反应速率的因素是氧气的浓度;夏天,将食品放在冰箱里不容易变质,这一事例说明温度也能影响化学反应速率,温度如何影响反应速率呢?
(2)猜想与假设
温度越高,反应速率越快
(3)收集证据
实验药品:颗粒大小相同的锌粒;两份相同溶质质量分数.不同温度的稀硫酸(20℃、40℃)
供选仪器:药匙、气体发生装置2套(气密性良好)、量筒2支、分液漏斗、秒表、胶头滴管、水槽、大试管2支.利用上述仪器和药品,补充完成下表的实验报告.
| 观察或测量的量 | 选用的仪器 | 实验步骤 | 实验现象 | 实验结论 |
| 产生相同体积(一试管)的气体所需时间 | 气体发生装置、秒表、胶头滴管、水槽、大试管、 药匙、量筒 | 温度越高,反应速率越快.反应的化学方程式是Zn+H2SO4═ZnSO4+H2↑ |
(4)结论与解释
从微观的角度分析“温度越高,反应速率越快”的原因是温度升高,粒子的运动的速率加快,有效碰撞机会增加.
(5)拓展分析
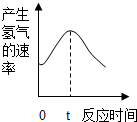
根据其他测定方位,实验小组的同学绘制了锌粒与稀硫酸反应产生氢气的速率随时间变化的曲线,如图所示,请据图分析:时间0-t内,反应速率逐渐加快的主要原因是锌与稀硫酸反应放热,温度升高,反应速率加快,时间t以后,反应速率逐渐减慢的主要原因是随着反应的进行,反应物的浓度越来越小,反应速率减慢.
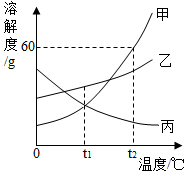 图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )
图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )| A. | t1℃时,三种固体物质的溶解度关系为乙>甲=丙 | |
| B. | t2℃100g甲物质饱和溶液中含有60g甲 | |
| C. | 将丙物质饱和溶液变为不饱和溶液,可采用升温的方法 | |
| D. | t2℃时,分别用100g水配制甲、乙的饱和溶液,再降温到t1℃,析出无水晶体的质量:甲>乙 |