��Ŀ����
8��̼��������Ҫ�Ļ���ԭ�ϣ��Դ���Ϊԭ������̼���ƵĹ������£��ش��������⣺������һ�������ᴿ
���Σ��������Ȼ��ơ��Ȼ�þ�����ʣ��������õ�ʳ��ˮ����Ҫ������ͼ1��ʾ��
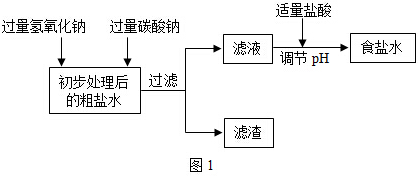
��1��д��̼�������Ȼ��Ʒ�Ӧ�Ļ�ѧ����ʽCaCl2+Na2CO3=2NaCl+CaCO3����
��2����Һ��������������NaCl��Na2CO3��NaOH��
��3��������ҺpH����ʹ�÷�̪��ҺΪָʾ�������۲쵽��Һ��ɫǡ����A�����ţ��仯ʱ��˵����Һ�����ԣ�
A����ɫ����ɫ B����ɫ����ɫ C����ɫ����ɫ
��4�������в������������ҺPH��ԭ���ǻ�����µ����ʣ�
�����������̼������
���Ȼ�����̼����泥�NH4HCO3����Ӧ���Ƶ�̼����泥�NaHCO3����
��Ӧԭ����NaCl+NH4HCO3�TNaHCO3��+NH4Cl
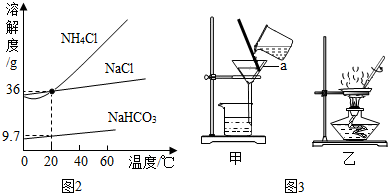
NaCl��NaHCO3 ��NH4Cl ���ܽ��������ͼ2��ʾ��
��1����ͬ�����£��Ȼ��Ƶ��ܽ�ȴ����Ȼ�泥�Ӧ������¶ȷ�Χ��0�棼t��20�森
��2��20��ʱ����100g ˮ�м���11.7g ��NaCl��15.8gNH4HCO3ǡ����ȫ��Ӧ�������Ͽ�����NaHCO3�������Ƕ��٣�ʵ���ϴ���Һ������NaHCO3���������Ϊ���٣���д��������̣����������0.1g ��
��3���������Һ��������NaHCO3����Ӧѡ��ͼ3�еļ�
����ס����ҡ���װ�ã��÷�������в�������������������
��4��д��ͼ3�в�������a �����ƣ�©����
������������̼����
̼�����Ƽ��Ⱥ������̼���ơ�ˮ�Ͷ�����̼��д����Ӧ�Ļ�ѧ����ʽ��2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2����
���� ������һ����1������̼�������Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ��ƽ��з�����
��2�����ݴ����е����ʺ������Լ��ķ�Ӧ���з�����
��3��������Һ������Լ����ָʾ���ı�ɫ������з�����
��4�����ݳ����ʵ�ԭ�����������ʽ��з�����
�����������1�������Ȼ��ƺ��Ȼ�淋��ܽ�����߽��з�����
��2������11.7g��NaCl��15.8g��NH4HCO3�����л�ѧ����ʽ���㣬�������NaHCO3���������������ʵ���ϴ���Һ������NaHCO3�Ĺ���������
��3�����ݷ���̡�Һ��IJ���ѡװ�ã����������������ã�
��4��������ͼ3��ʾ��������д�����ƣ�
��������������̼�������ڼ��ȵ�����������̼���ơ�ˮ�Ͷ�����̼���з�����
��� �⣺������һ����1��̼�������Ȼ��Ʒ�Ӧ����̼��ƺ��Ȼ��ƣ���ѧ����ʽΪ��CaCl2+Na2CO3=2NaCl+CaCO3����
��2������ˮ�к����Ȼ�þ���Ȼ��Ƶ����ʣ��������������������Һ��̼������Һ���ַ�Ӧ�������Ȼ��ƣ�������Һ�л���ʣ�������������Һ��̼������Һ��
��3��̼���ƺ�����������Һ���Լ��ԣ�����ɫ��̪��죬����Һ�ɺ�ɫ��Ϊ��ɫʱ����Һ��Ϊ���ԣ�
��4�������в������������ҺpH��ԭ���ǻ����Na2SO4�����������ʣ�
�����������1����ͼ���֪����ͬ�����£��Ȼ��Ƶ��ܽ�ȴ����Ȼ�泥�Ӧ������¶ȷ�Χ��0-20�棻
��2�������������ɵ�̼����������Ϊx
NaCl+NH4HCO3�TNaHCO3��+NH4Cl
58.5 84
11.7g x
$\frac{58.5}{11.7g}$=$\frac{84}{x}$
x=16.8g
ʵ������NaHCO3���������Ϊ��16.8g-9.7g=7.1g��
��3����Һ����Ӧѡ��ͼ3�еļ���װ�ã��������ڸò����е�������������
��4����ͼ3��ʾ��������a��������©����
����������̼�������ڼ��ȵ�����������̼���ơ�ˮ�Ͷ�����̼����ѧ����ʽΪ��2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2����
�ʴ�Ϊ��������һ����1��CaCl2+Na2CO3=2NaCl+CaCO3����
��2��NaCl��Na2CO3��NaOH��
��3��A��
��4��������µ����ʣ�
�����������1��0�棼t��20�棻
��2�����������ɵ�̼������Ϊ16.8g��ʵ������NaHCO3����Ϊ7.1g��
��3���ף�������
��4��©����
����������2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2����
���� �����ѶȱȽϴ��漰�����ᴿ��ԭ�������ӵ�ԭ���������Ƽ��ԭ�����������ݣ�Ҫͨ�����������ܽ����˼·��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | �ϱ����������ڻ� | B�� | ������ɳʯǨ�� | ||
| C�� | ����ʯ�͵��γ� | D�� | ��������ת�� |
| A�� | ��ҵ������ʯ�Ҵ������᳧����ˮ | |
| B�� | ����ȱп�ᵼ�������������������пԪ�������Խ��Խ�� | |
| C�� | �̬��������Է��ϻ��ʹ�ÿ���������߷�Ч | |
| D�� | �����г��õ����ϡ��Ͻ𡢲����ֵ����ʶ��Ǹ��ϲ��� |
 �������������������������أ��ι����ս�����֪ʶʮ�ֱ�Ҫ��
�������������������������أ��ι����ս�����֪ʶʮ�ֱ�Ҫ��
