题目内容
6.在电缆生产过程中,不可能避免地会产生一定量的含铜废料(如:零碎电缆),某化学兴趣小组的三位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法.甲同学根据已学知识,提出了一套回收方案.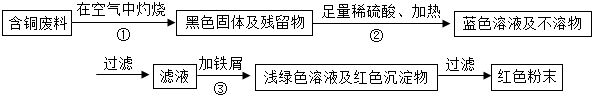
(1)甲同学的方案中步骤③的化学反应方程式是:Fe+CuSO4═FeSO4+Cu;
(2)乙同学认为,甲同学在步骤③“加铁屑”这一步时,应该加入略过量的铁屑,你认为他这么说的道理是:确保CuSO4用完 或 将铜完全置换;
(3)丙同学又提出了疑问:“如果铁过量,剩余的铁会混在红色粉末中,该用什么化学方法处理?”请提出你的想法:加入适量的酸除去剩余的铁屑,将所得的铜粉酸洗后再洗涤,干燥 或 过滤前先加适量的酸除去剩余的铁粉;
(4)由Cu制取CuSO4溶液有以下两种途径:
①Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
②2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO CuO+H2SO4═CuSO4+H2O
你认为最佳途径是②(填序号),理由是无污染、节约H2SO4.
分析 (1)根据设计方案和方程式书写方法进行分析;
(2)根据设计方案和置换反应进行分析;
(3)可以加入适量的酸除去剩余的铁屑,将所得的铜粉酸洗后再洗涤,干燥 或 过滤前先加适量的酸除去剩余的铁粉;
(4)评价实验方案要从反应的可操作性,生成物的性质,环保节能等方面分析.由于浓硫酸与铜直接反应时会生成有毒的二氧化硫,且需要的硫酸量较大所以一般不采用这种方式进行.
解答 解:(1)铁屑与硫酸铜反应置换出铜,反应方程式为:Fe+CuSO4═FeSO4+Cu;
故答案为:Fe+CuSO4═FeSO4+Cu;
(2)加入略过量的铁屑,是将硫酸铜全部置换出来;故答案为:确保CuSO4用完 或 将铜完全置换;(3)如果铁过量,会混在红色粉末中,可以加入适量的酸除去剩余的铁屑,将所得的铜粉酸洗后再洗涤,干燥 或 过滤前先加适量的酸除去剩余的铁粉,故填:加入适量的酸除去剩余的铁屑,将所得的铜粉酸洗后再洗涤,干燥 或 过滤前先加适量的酸除去剩余的铁粉.
(4)在浓硫酸与铜的反应中不但生成了污染物二氧化硫,而且还消耗了较多的硫酸,因为硫以二氧化硫的形式跑掉了一部分,而利用将铜屑在空气中加热氧化,然后浸入稀硫酸中反应过滤,有效地避免了这一些.
故答案为:②;无污染、节约H2SO4.
点评 本题考查通过实验现象,综合利用所学知识进行分析解题的能力,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列各选项中,括号内物质是除去杂质所用的试剂(适量).其中正确的是( )
| A. | 银粉中混有铁粉(硫酸铜溶液) | |
| B. | 氯化钠中混有碳酸钠(盐酸溶液) | |
| C. | 氯化铜溶液中混有氯化亚铁(铜粉) | |
| D. | 二氧化碳气体中混有氧气(氢氧化钠溶液) |
17. 构建知识网络是一种重要的学习方法.如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A、B、C分别属于不同类别的化合物.则A、B、C可能是( )
构建知识网络是一种重要的学习方法.如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A、B、C分别属于不同类别的化合物.则A、B、C可能是( )
 构建知识网络是一种重要的学习方法.如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A、B、C分别属于不同类别的化合物.则A、B、C可能是( )
构建知识网络是一种重要的学习方法.如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A、B、C分别属于不同类别的化合物.则A、B、C可能是( )| A. | KOH、CuSO4、Na2CO3 | B. | Ba(OH)2、CuSO4、CuO | ||
| C. | Ca(OH)2、HNO3、K2CO3 | D. | NaOH、HCl、Ba(NO3)2 |
14.达菲对人感染H7N9禽流感病毒繁殖有一定的抑制作用,达菲的化学式为C16H28N2O4•H3PO4.下列关于达菲的叙述正确的是( )
| A. | 达菲由六种元素组成 | |
| B. | 达菲分子中含有7种元素的原子 | |
| C. | 达菲中氮元素的质量分数为50% | |
| D. | 达菲中氮、磷两种元素的质量比为28:31 |
1.下列操作或现象与分子对应的特征不一致的选项是( )
| 选项 | 操作或现象 | 分子的特性 |
| A | 给篮球充气 | 分子间有间隔 |
| B | 100mL酒精和100mL水混合在一起,体积小于200mL | 分子是有质量的 |
| C | 在花园中可闻到花的香味 | 分子是运动的 |
| D | 加热氧化汞可得到金属汞和氧气 | 分子是可以再分的 |
| A. | A | B. | B | C. | C | D. | D |
11.在化学反应前后,肯定不会变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和 ⑤物质的种类 ⑥物质的体积.
①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和 ⑤物质的种类 ⑥物质的体积.
| A. | ②④⑤ | B. | ①③⑥ | C. | ①③④ | D. | ①④⑥ |
18.分子和原子的最本质区别的是( )
| A. | 分子大,原子小 | |
| B. | 分子能构成物质,原子不能 | |
| C. | 分子在运动,原子不能 | |
| D. | 分子在化学变化中可以再分,原子不能 |

 金属铁及其化合物之间有如图转化关系.
金属铁及其化合物之间有如图转化关系.