题目内容
5.某同学为了研究实验室中用某氯酸钾样品制氧气的有关问题,他将5g该样品与1g二氧化锰混合,加热该混合物(假设杂质不参加反应),在不同时间测得有关数据如表:| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量/g | 5.04 | / | 4.08 | / |
| 生成氧气的质量/g | / | 1.84 | / | 1.92 |
(2)该样品中氯酸钾的质量分数为多少?
分析 根据氯酸钾制氧气的化学方程式可知,当反应完成以后,固体的质量是不会变化的.结合表格信息可以发现,第三次和第四次的剩余固体的质量都是4.08g,说明反应已经完成.根据质量守恒定律可知,氧气的质量等于5g+1g-4.08=1.92g,然后写出化学方程式并代入数据计算即可得到结果.
解答 解:(1)反应前物质的总质量减去剩余固体的质量就是生成的氧气的质量,计算数据如表中数据.
| 加热时间T/min | T1=1 | T2=3 | T3=5 | T4=7 |
| 剩余固体质量/g | 5.04 | 4.16 | 4.08 | 4.08 |
| 生成氧气质量/g | 0.96 | 1.84 | 1.92 | 1.92 |
故填:是;1;
(2)设氯酸钾的质量为x
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 96
x 1.92g
$\frac{245}{96}=\frac{x}{1.92g}$
x=4.9g
该样品中氯酸钾的质量分数为:$\frac{4.9g}{5g}×100%$=98%.
答:该样品中氯酸钾的质量分数为98%.
点评 关键是判断反应的停止时间和氧气的质量计算方法,注意根据化学方程式计算的规范性.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
10.碳纳米管是一种由碳原子构成直径为几个纳米(1nm=10-9 m)的空心管.下列说法错误的是( )
| A. | 碳纳米管材料是一种新型的有机化合物 | |
| B. | 碳纳米管材料如果完全燃烧,生成物是CO2 | |
| C. | 碳纳米管材料管道多,表面积大,吸附能力强 | |
| D. | 碳纳米管材料在常温下化学性质稳定 |
17.一瓶气体经测定只含一种元素,下列叙述正确的是( )
| A. | 可能是化合物 | B. | 一定是单质 | C. | 可能是混合物 | D. | 一定是化合物 |
14.在日常生活和农业生产中,下列物质用途是由化学性质决定的是( )
| A. | 用活性炭除去冰箱内的异味 | B. | 用一氧化碳作燃料 | ||
| C. | 用金属铜制作电线 | D. | 用金刚石刻划玻璃 |
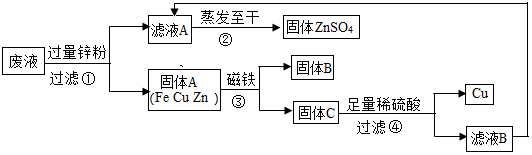 实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染.于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如图所示:
实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染.于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如图所示:

 ;
;