题目内容
8.下列实际应用中,与中和反应原理无关的是( )| A. | 用氢氧化钠溶液洗涤石油产品中的残余硫酸 | |
| B. | 用酸洗去金属表面的铁锈 | |
| C. | 用熟石灰改良酸性土壤 | |
| D. | 用稀氨水涂抹在蚊子叮咬处(蚊子能分泌出蚁酸)止痒 |
分析 中和反应是酸与碱作用生成盐和水的反应,反应物是酸和碱,生成物是盐和水,据此进行分析判断.
解答 解:A、用氢氧化钠溶液洗涤石油产品中残留硫酸,氢氧化钠溶液与硫酸反应生成硫酸钠和水,该反应是酸与碱反应生成盐和水的反应,属于中和反应,故选项错误.
B、用酸洗去金属表面的铁锈,是利用了铁锈的主要成分氧化铁与稀硫酸反应生成硫酸铁和水,该反应的反应物是酸和金属氧化物,不属于中和反应,故选项正确.
C、用熟石灰改良酸性土壤,熟石灰是氢氧化钙的俗称,与酸性土壤中的酸反应生成盐和水,属于中和反应,故选项错误.
D、用稀氨水涂抹在蚊子叮咬处(蚊子能分泌出蚁酸)止痒,稀氨水与蚁酸发生中和反应,是酸与碱反应生成盐和水的反应,属于中和反应,故选项错误.
故选:B.
点评 本题难度不大,掌握中和反应的特征(反应物是酸和碱,生成物是盐和水)是正确解答此类题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.生活中的下列做法不正确的是( )
| A. | 用食醋除去暖水瓶中的水垢 | |
| B. | 用燃烧的方法鉴别衣料中的羊毛纤维 | |
| C. | 儿童患佝偻病是因为体内缺乏微量元素碘 | |
| D. | CO(NH2)2(尿素)、(NH4)2SO4和NaNO3均可用作氮肥 |
16.工程技术人员通常利用铝热剂燃烧释放大量的热来焊接铁轨.点燃铝热剂反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;点燃\;}}{\;}$2Fe+Al2O3,下列叙述错误的是( )
| A. | 该反应是置换反应 | |
| B. | 该反应中铝发生的是氧化反应 | |
| C. | 生成物中的铁的化合价为+3价 | |
| D. | 焊接过程中既有物理变化又有化学变化 |
3.在一个密闭容器中放人甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应结束后,测得部分数据如表.下列说法中,正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 18 | 1 | 2 | 32 |
| 反应后质量/g | X | 26 | 2 | 12 |
| A. | 乙是反应物 | B. | 无法确定X的值 | ||
| C. | 该反应可能是复分解反应 | D. | 物质丙可能是该反应的催化剂 |
13.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 凡含有食品添加剂的食物对人体健康均有害,不可食用 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 提倡人们购物时不用塑料袋,主要是为了防止白色污染和节约资源 |
20.下列化学用语书写正确的是( )
| A. | 硫酸钾:KSO4 | B. | 钙离子:Ca+2 | ||
| C. | 2个氮原子:N2 | D. | 显+2价的镁元素:$\stackrel{+2}{Mg}$ |
17.实验设计是化学实验的重要环节,请根据下列实验要求回答相关问题:
【活动与探究一】用对比实验方法探究二氧化碳的性质.
(1)实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;对比A瓶与C(填“B”或“C”) 瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是湿润的蓝色石蕊试纸变红,而干燥的不变,结论是CO2与水反应变成碳酸,碳酸能使紫色石蕊试纸变红(用语言表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
(3)实验三目的是探究温度对硝酸钾溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响.
【活动与探究一】用对比实验方法探究二氧化碳的性质.
| 实验一 | 实验二 |
 |  |
(2)实验二观察到C装置中发生的现象是湿润的蓝色石蕊试纸变红,而干燥的不变,结论是CO2与水反应变成碳酸,碳酸能使紫色石蕊试纸变红(用语言表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
| 实验三 | 实验四 |
 |  |
18.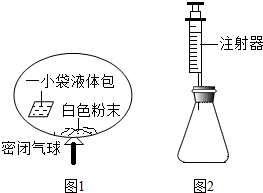 某研究小组对自动充气气球(示意图如图1)进行下列探究.
某研究小组对自动充气气球(示意图如图1)进行下列探究.
[查阅资料]该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为检验气体是二氧化碳,可选用氢氧化钙溶液(填试剂名称).
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈酸性.
探究二:白色粉末成分的探究
[猜想与假设]甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠.
[设计并进行实验]
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想不正确(填“正确”或“不正确”).
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:
实验①的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;表中a=0.1;V1>V2(填“>”、“<”或“=”).
[分析并得出结论]
(5)如何从上表中获取证据并得出结论?根据实验1.3可知,最终得到的二氧化碳体积相等,因此,白色粉末是碳酸氢钠.
 某研究小组对自动充气气球(示意图如图1)进行下列探究.
某研究小组对自动充气气球(示意图如图1)进行下列探究.[查阅资料]该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为检验气体是二氧化碳,可选用氢氧化钙溶液(填试剂名称).
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈酸性.
探究二:白色粉末成分的探究
[猜想与假设]甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠.
[设计并进行实验]
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想不正确(填“正确”或“不正确”).
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:
| 实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
| 名称 | 质量/g | ||
| ① | 碳酸氢钠 | 0.10 | V1 |
| ② | 碳酸钠 | 0.10 | V2 |
| ③ | 白色粉末 | a | V1 |
[分析并得出结论]
(5)如何从上表中获取证据并得出结论?根据实验1.3可知,最终得到的二氧化碳体积相等,因此,白色粉末是碳酸氢钠.
