题目内容
16.将含3克氯酸钾和1克二氧化锰的混合物加热片刻,冷却,称得残余固体的质量为3.04克,根据质量守恒定律可知,生成氧气的质量为多少克?固体残余物中含什么物质?分析 根据氯酸钾分解的反应原理和质量守恒定律可知,固体质量的减小值等于氧气的质量,然后写出化学方程式并代入氧气的质量计算出氯酸钾的质量,最后计算出氯化钾的质量.
解答 解:根据质量守恒定律可知,减少的固体的质量等于氧气的质量,因此氧气的质量=3g+1g-3.04g=0.96g;
氯酸钾分解生成氯化钾和氧气,二氧化锰是反应的催化剂,反应前后其质量不变,所以固体残余物中含有二氧化锰、氯化钾,还可能含有未分解的氯酸钾;
设生成氯化钾的质量是x
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
149 96
x 0.96g
$\frac{149}{96}=\frac{x}{0.96g}$ 解得 x=1.49g
∵化学反应前后催化剂(二氧化锰)的质量保持不变.
∴残余物中还含有氯酸钾,氯酸钾的质量=3.04g-1.49g-1g=0.55g
答:生成氧气的质量为0.96g;固体残余物中含有氯化钾、二氧化锰和剩余的氯酸钾;其中二氧化锰1g,剩余氯酸钾0.55g,和生成的氯化钾1.49g.
点评 掌握化学方程式的计算格式和规范性及质量守恒定律的应用,并注意:反应前后催化剂的化学性质和质量均不变.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
7.有四种溶液,分别是盐酸、硫酸铜溶液、氯化铁溶液、无色酚酞试液,用一种试剂就可以将它们区别开来,应选用的试剂是( )
| A. | NaOH | B. | H2SO4 | C. | AgNO3 | D. | BaCl2 |
4.下列各组物质中能相互反应且属于复分解反应的是( )
| A. | 氢氧化镁和稀盐酸 | B. | 二氧化碳和石灰水 | ||
| C. | 氯化钾溶液和硝酸钠溶液 | D. | 锌和硫酸 |
6.下列说法中,符合科学道理的是( )
| A. | 本药品对人体无任何副作用 | |
| B. | 长期饮用纯净水有益身体健康 | |
| C. | 吸带过滤嘴的香烟对人体无害 | |
| D. | 节日庆祝大量燃放烟花爆竹会造成空气的污染 |
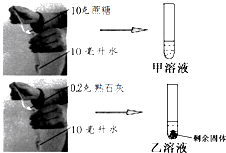 小明同学为探究物质的溶解性进行如图实验,图中环境温度为20℃,从图中数据分析可知:
小明同学为探究物质的溶解性进行如图实验,图中环境温度为20℃,从图中数据分析可知: 实验室里有一标签被腐蚀的试剂瓶,如图所示,里面装有无色透明的溶液,郑老师取少量该溶液,加入酚酞试液后变红,再加入足量稀盐酸,溶液红色褪去并有气泡产生,如果溶液中只有一种溶质,该溶质的化学式为Na2CO3或NaHCO3.
实验室里有一标签被腐蚀的试剂瓶,如图所示,里面装有无色透明的溶液,郑老师取少量该溶液,加入酚酞试液后变红,再加入足量稀盐酸,溶液红色褪去并有气泡产生,如果溶液中只有一种溶质,该溶质的化学式为Na2CO3或NaHCO3.