题目内容
甲、乙两个烧杯中盛有质量分数和质量均相等的稀硫酸,分别向两烧杯中加入等质量的镁条和铁片,若反应后两烧杯中酸均有剩余,则两烧杯中产生氢气质量的最简整数比为________;若反应后金属均有剩余,则两烧杯中消耗金属质量的最简整数比为________.
7:3 3:7
分析:如果硫酸是少量的,则消耗的金属质量和产生的氢气量是由硫酸决定,产生相同的氢气,有金属剩余;如果硫酸过量,则产生的氢气量由金属决定,产生的氢气量不同.
解答:(1)两烧杯中酸有剩余,说明金属不足,产生氢气量有金属决定,
设56g镁与硫酸反应生成xg氢气
Fe+H2SO4═FeSO4+H2↑
56g 2g
Mg+H2SO4═MgSO4+H2↑
24 2
56g xg
 x=
x=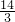
镁与铁产生氢气质量比为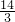 :2=7:3;
:2=7:3;
(2)当反应后金属都有剩余时,硫酸不足,消耗的金属质量由硫酸决定,
Fe+H2SO4═FeSO4+H2↑
56 98
Mg+H2SO4═MgSO4+H2↑
24 98
消耗的镁与铁的质量比为24:56=3:7
故答案为:
①7:3;②3:7.
点评:根据金属的化学性质,考虑到多种情况是解答本题的关键.
分析:如果硫酸是少量的,则消耗的金属质量和产生的氢气量是由硫酸决定,产生相同的氢气,有金属剩余;如果硫酸过量,则产生的氢气量由金属决定,产生的氢气量不同.
解答:(1)两烧杯中酸有剩余,说明金属不足,产生氢气量有金属决定,
设56g镁与硫酸反应生成xg氢气
Fe+H2SO4═FeSO4+H2↑
56g 2g
Mg+H2SO4═MgSO4+H2↑
24 2
56g xg
 x=
x=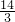
镁与铁产生氢气质量比为
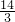 :2=7:3;
:2=7:3;(2)当反应后金属都有剩余时,硫酸不足,消耗的金属质量由硫酸决定,
Fe+H2SO4═FeSO4+H2↑
56 98
Mg+H2SO4═MgSO4+H2↑
24 98
消耗的镁与铁的质量比为24:56=3:7
故答案为:
①7:3;②3:7.
点评:根据金属的化学性质,考虑到多种情况是解答本题的关键.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
t℃时,甲、乙两个烧杯中各盛有100g相同浓度的KCl溶液.现将甲烧杯中的溶液蒸发掉35.0g H2O,恢复到t℃时,析出KCl固体5.0g;乙烧杯中的溶液蒸发掉45.0gH2O,恢复到t℃时,析出KCl固体10.0g.下列说法正确的是( )
| A、原溶液的质量分数为33.3% | B、t℃时,KCl的溶解度为50.0g | C、原溶液的质量分数为50% | D、两烧杯中剩余溶液的溶质质量分数不同 |