题目内容
2.为了测定氢氧化钠样品中的质量分数,取25g该样品溶于水,然后加入100g氢氧化钡溶液,恰好完全反应,反应生成19.7g沉淀,计算:(1)样品中氢氧化钠的质量分数.
(2)不能(填“能”或“不能”)选用氯化钡溶液来除去碳酸钠杂质.
分析 氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,碳酸钠能和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,根据沉淀碳酸钡的质量可以计算氢氧化钠的质量,进一步可以计算样品中氢氧化钠的质量分数.
解答 解:(1)设氢氧化钠的质量为x,
Na2CO3+Ba(OH)2═BaCO3↓+2NaOH,
106 197
25g-x 19.7g
$\frac{106}{25-x}$=$\frac{197}{19.7g}$,
x=14.4g,
样品中氢氧化钠的质量分数为:$\frac{14.4g}{25g}$×100%=57.6%,
答:样品中氢氧化钠的质量分数是57.6%.
(2)因为氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠,在除去碳酸钠的同时,带入了新的杂质氯化钠,因此不能用氯化钡溶液来除去碳酸钠杂质.
故填:不能.
点评 除去杂质时,在除去杂质的同时不能带入新的杂质,都是原物质的质量可以增加,不能减少.

练习册系列答案
相关题目
13.下面是某同学在实验时记录的实验现象,其中与事实不相符的是( )
| A. | 在纯碱溶液中滴加几滴石蕊试液,溶液呈红色 | |
| B. | 在稀硫酸中加入铁粉,溶液逐渐变成浅绿色 | |
| C. | 加热饱和石灰水,出现白色浑浊 | |
| D. | 在氢氧化钠溶液中滴加硫酸铜溶液,出现蓝色沉淀 |
10.电子业、工业、轨道交通等的发展,使重庆正在走向一个更新、更高的台阶.而修建地铁所用的主要材料之一是锰钢.锰钢属于( )
| A. | 合成材料 | B. | 金属材料 | C. | 纯净物 | D. | 有机物 |
7.(1)有一包白色晶体的化肥,将它与熟石灰一起研磨,有浓烈的刺激性气味,初步判定是一种氮肥(填“氮肥”、“钾肥”或“磷肥”).
(2)为进一步证实肥料的成分,小明将少量肥料样品带到学校进行探究.
(3)结合上述实验回答:
①该化肥是一种铵盐,有同学认为盐的水溶液都呈中性,该观点不正确,举例说明:碳酸钠溶液呈碱性
②结合实验过程回答,施用该化肥时应注意:a.不宜长期施用该肥料以使土壤酸化、板结;b.不能与碱性物质混合施用(再写一条即可).
(2)为进一步证实肥料的成分,小明将少量肥料样品带到学校进行探究.
| 探究内容 | 现 象 | 结 论 |
| 实验1:取一定量的肥料放入水中,振荡 | 样品完全溶解 | 该肥料不是磷肥 |
| 实验2:取实验1中的部分溶液,滴加紫色石蕊溶液 | 溶液变红 | 溶液呈酸性 |
| 实验3:另取实验1中的部分溶液,滴加氯化钡试剂和稀盐酸 | 有白色沉淀生成 | 该化肥为硫酸铵 |
①该化肥是一种铵盐,有同学认为盐的水溶液都呈中性,该观点不正确,举例说明:碳酸钠溶液呈碱性
②结合实验过程回答,施用该化肥时应注意:a.不宜长期施用该肥料以使土壤酸化、板结;b.不能与碱性物质混合施用(再写一条即可).
14.下列各组物质的组成元素相同但性质不同,其中由粒子的不同引起的是( )
| A. | 金刚石和石墨 | B. | 氧气和臭氧 | ||
| C. | 盐酸和硫酸 | D. | 二氧化碳和一氧化碳 |
7.在气焊、炼钢、医疗、登山等生产、生活中,都离不了的一种气体是( )
| A. | 水蒸气 | B. | 氧气 | C. | 氮气 | D. | 二氧化碳 |
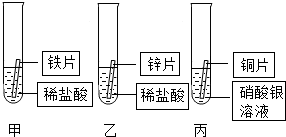 某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同).
某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同).


