题目内容
18. 向50g硫酸和硫酸铜的混合溶液中逐渐滴加氢氧化钠溶液,产生沉淀质量与加入氢氧化钠溶液质量关系如图所示,完成以下问题:
向50g硫酸和硫酸铜的混合溶液中逐渐滴加氢氧化钠溶液,产生沉淀质量与加入氢氧化钠溶液质量关系如图所示,完成以下问题:(1)所得溶液在A点时溶质是硫酸钠、硫酸铜;
(2)原混合溶液中溶质硫酸铜的质量分数是多少?
分析 稀硫酸和氢氧化钠反应生成硫酸钠和水,硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,根据反应生成沉淀的质量可以计算硫酸铜的质量,进一步可以计算原混合溶液中溶质硫酸铜的质量分数.
解答 解:(1)所得溶液在A点时溶质有反应生成的硫酸钠和没有反应的硫酸铜.
故填:硫酸钠、硫酸铜.
(2)设硫酸铜质量为x,
2NaOH+CuSO4═Na2SO4+Cu(OH)2↓,
160 98
x 9.8g
$\frac{160}{x}$=$\frac{98}{9.8g}$,
x=16g,
原混合溶液中溶质硫酸铜的质量分数是:$\frac{16g}{50g}$×100%=32%,
答:原混合溶液中溶质硫酸铜的质量分数是32%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13. 如图是A、B、C三种物质的溶解度曲线,说法错误的是( )
如图是A、B、C三种物质的溶解度曲线,说法错误的是( )
 如图是A、B、C三种物质的溶解度曲线,说法错误的是( )
如图是A、B、C三种物质的溶解度曲线,说法错误的是( )| A. | 物质A的溶解度随温度的升高而增大 | |
| B. | t1℃时,物质C饱和溶液的溶质质量分数为20% | |
| C. | 将t2℃时物质C的饱和溶液降温到t1℃时,溶液浓度变大 | |
| D. | 将t2℃时的物质A、B饱和溶液降温到t1℃时,两溶液的浓度B>A |
3.下面是某同学进行化学性质实验时记录的实验现象,其中与事实不相符的是( )
| A. | 将光洁的铁钉放入硫酸铜溶液中,铁钉表面有红色固体析出 | |
| B. | 在NaOH 溶液中加入CuSO4溶液,有蓝色沉淀生成 | |
| C. | 在稀盐酸中加入几滴石蕊溶液,溶液呈蓝色 | |
| D. | 用一氧化碳还原氧化铁,可观察到红棕色固体逐渐变成黑色 |
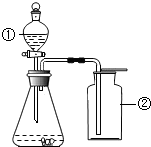 如图是李华同学设计的分解过氧化氢制取并收集氧气的装置图(①为分液漏斗,活塞可随时开关以控制液体滴加速度).请回答下列问题:
如图是李华同学设计的分解过氧化氢制取并收集氧气的装置图(①为分液漏斗,活塞可随时开关以控制液体滴加速度).请回答下列问题: (1)规范的实验操作是实验成功的前提.请回答:
(1)规范的实验操作是实验成功的前提.请回答: