题目内容
14. 为测定某小苏打样品(含少量氯化钠杂质)中碳酸氢钠的含量,取10g样品放入烧杯中,加入足量稀盐酸,测得生成气体的质量与反应时间的关系如图所示:
为测定某小苏打样品(含少量氯化钠杂质)中碳酸氢钠的含量,取10g样品放入烧杯中,加入足量稀盐酸,测得生成气体的质量与反应时间的关系如图所示:(1)反应生成CO2质量为4.4g;
(2)求该小苏打样品中碳酸氢钠的质量分数;
(3)某同学将上述反应后所得溶液蒸干,称量其固体质量来测定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果将偏高(填“偏高”“偏低”或“不受影响”)
分析 由质量关系图可知,当加入稀盐酸时,恰好完全反应,生成二氧化碳气体4.4g;
根据4.4g二氧化碳可计算参加反应的碳酸氢钠质量、反应生成氯化钠的质量;
反应所得溶液中氯化钠的质量=小苏打中氯化钠质量+反应后生成的氯化钠质量.
解答 解:(1)反应生成CO2质量为4.4g;故答案为:4.4;
(2)设碳酸氢钠的质量为x,生成的氯化钠的质量为y.
NaHCO3+HCl=NaCl+H2O+CO2↑
84 58.5 44
x y 4.4g
$\frac{84}{x}=\frac{44}{4.4g}$,
x=8.4g
$\frac{58.5}{y}=\frac{44}{4.4g}$,
y=5.85g
样品中碳酸氢钠的质量分数=$\frac{8.4g}{10g}$×100%=84%;
答:样品中碳酸氢钠的质量分数为84%;
(3)若蒸发过程中有少量液体溅出,蒸干后所得固体质量偏小,则小苏打含量偏高,故答案为:偏高.
点评 溶液的溶质质量分数与化学方程式相结合的综合运用,根据图示信息查找反应中的已知量进行求解.

练习册系列答案
相关题目
4.下列实验操作中,正确的是( )
| A. |  滴加液体 | B. |  过滤 | C. |  稀释浓硫酸 | D. |  称量固体 |
2.甲、乙两物质的溶解度与温度的关系如图所示,下列说法正确的是( )
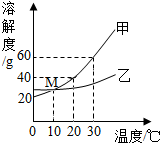

| A. | 30℃时乙的溶解度为60g | B. | 乙的溶解度随温度的升高而降低 | ||
| C. | 20℃时甲的溶解度小于乙的溶解度 | D. | M点表示10℃时两物质的溶解度相等 |
5.当前食品安全备受人们关注,下列做法会危及人体健康的是( )
| A. | 长期饮用白开水 | B. | 蒸馒头加适量小苏打 | ||
| C. | 提炼地沟油作为餐饮用油 | D. | 用干冰保藏易变质的食品 |
2.空气中氧气和氮气的体积比约为( )
| A. | 1:5 | B. | 5:1 | C. | 1:4 | D. | 4:1 |
3. 如图分别是某元素的原子结构示意图及该元素在元素周期表中的相关信息,下列说法正确的是( )
如图分别是某元素的原子结构示意图及该元素在元素周期表中的相关信息,下列说法正确的是( )
 如图分别是某元素的原子结构示意图及该元素在元素周期表中的相关信息,下列说法正确的是( )
如图分别是某元素的原子结构示意图及该元素在元素周期表中的相关信息,下列说法正确的是( )| A. | 该元素的原子序数为9 | |
| B. | 该元素原子的中子数为19 | |
| C. | 该元素是金属元素 | |
| D. | 在化学反应过程中该元素原子容易得到电子形成F+ |

