题目内容
8.含锌30%的黄铜用作弹壳的制造.现有一批使用过的、锈迹斑斑的弹壳,处理这些弹壳可以制得铜和硫酸锌,其主要过程如图所示.提示:弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、不参加反应.
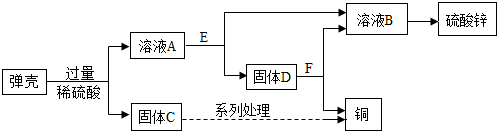
(1)固体D为Zn和Cu.
(2)溶液A中加入E后发生反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑,Zn+CuSO4═ZnSO4+Cu.
分析 根据碱式碳酸铜能与硫酸反应生成硫酸铜、水和二氧化碳,硫酸铜能与锌反应生成硫酸锌和铜,溶液B是硫酸锌,固体D能与硫酸反应生成无色气体E,则D中除了含有铜,还含有锌,然后进行验证即可.
解答 解:(1)碱式碳酸铜与硫酸反应生成硫酸铜、水、二氧化碳,所以蓝色溶液B是硫酸铜溶液,E与硫酸铜溶液反应生成硫酸锌,所以E是锌,铁与硫酸铜反应生成了铜和硫酸锌,得到的固体D与硫酸反应后有气体生成,说明有锌剩余,锌与硫酸铜反应生成了铜,固体D中含有锌和铜;
(2)溶液A中加入E后发生的反应是锌和稀硫酸反应生成硫酸锌和氢气,锌和硫酸铜反应生成锌和铜,化学方程式为:Zn+H2SO4═ZnSO4+H2↑,Zn+CuSO4═ZnSO4+Cu.
故答案为:(1)Zn 和Cu;
(2)Zn+H2SO4═ZnSO4+H2↑,Zn+CuSO4═ZnSO4+Cu.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.不粘锅内表面通常使用特氟龙涂层,原料为聚四氟乙烯,其结构简式为[CF2CF2]n.对聚四氟乙烯的推断,不合理的是( )
| A. | 属于有机合成材料 | B. | 有较好的耐高温性 | ||
| C. | 可耐酸腐蚀 | D. | 可溶于酒精、食用油等有机溶剂 |
19.如图是甲、乙两种物质的溶解度曲线,则下列叙述正确的是( )
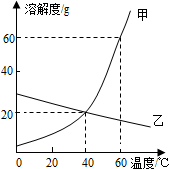

| A. | 50℃时,甲物质的溶解度大于乙物质的溶解度 | |
| B. | 40℃时,甲、乙两物质溶液的溶质质量分数一定相等 | |
| C. | 升高温度可以将乙的饱和溶液转化为不饱和溶液 | |
| D. | 可用100g水配制60℃时溶液质量为180g的甲溶液 |
 根据图回答问题.
根据图回答问题. 豆腐是生活中常见的食品,主要成分如右图所示.
豆腐是生活中常见的食品,主要成分如右图所示. 腐可以补充人体每天所需的钙元素,缺钙会导致的疾病是C(填字母序号).
腐可以补充人体每天所需的钙元素,缺钙会导致的疾病是C(填字母序号).
