题目内容
10.在一个密闭容器内有化合物X、氧气、二氧化碳、水,在一定条件下充分反应,测得反应前后各物质的质量如下:| 物质 | 化合物X | 二氧化碳 | 氧气 | 水 |
| 反应前质量(g) | 25 | 3 | 51 | 4 |
| 反应后质量(g) | m | 47 | 3 | 31 |
A.密闭容器内发生的基本反应类型为置换反应
B.化合物X中只含有C、H两种元素
C.化合物X中一定含C、H、O三种元素
D.密闭容器内生成物为二氧化碳和水.
分析 根据表中的数据,对比反应前后物质质量的变化,反应前后质量增加了,该物质就是生成物,增加了多少,就生成了多少,反应前后质量减少了,该物质就是反应物,减少了多少,参加反应的就是多少,质量不变是催化剂.
解答 解:由表中的数据可知,氧气反应后少了51-3=48g,说明反应了48g;二氧化碳多了47-3=44g,说明生成了44g二氧化碳;水蒸气多了31-4=27g,说明生成了27g水;根据质量守恒定律,X属于反应物,并且反应了27+44-48=23g,所以m值为25-23=2,算出二氧化碳中碳元素的质量为44g×$\frac{12}{44}$=12g,水中氢元素的质量为27g×$\frac{1×2}{18}$=3g,又因为二氧化碳中碳元素的质量、水中氢元素的质量都是由X中出来的,而12g+3g=15g<23g,所以M中有氧元素.所以,化合物X中一定含C、H、O三种元素;
A.由分析可知,生成物是二氧化碳和水,故密闭容器内发生的基本反应类型不属于置换反应;错误;
B.由分析可知,化合物X中一定含C、H、O三种元素;错误;
C.化合物X中一定含C、H、O三种元素;正确;
D.密闭容器内生成物为二氧化碳和水.正确;
答案:2;CD.
点评 本题解题的关键是利用比较的方法,根据图表中的数据先判断出反应物是谁,生成物是谁,分别反应了多少?生成了多少?再根据质量守恒定律进行推算.

练习册系列答案
相关题目
20.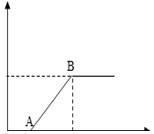 下表中的选项符合图所示的曲线的是( )
下表中的选项符合图所示的曲线的是( )
 下表中的选项符合图所示的曲线的是( )
下表中的选项符合图所示的曲线的是( )| 选项 | 横坐标 | 纵坐标 |
| A | 某温度下,向接近饱和的氯化钠溶液中加入氯化钠晶体 | 溶液中溶质的质量分数 |
| B | 向碳酸钠和碳酸钾混合溶液中加入稀盐酸的质量 | 产生气体的质量 |
| C | 向一定量的澄清石灰水和氢氧化钡混合溶液中加入碳酸钠溶液的质量 | 生成沉淀的质量 |
| D | 向氯化铁和盐酸的混合溶液中加入过量氢氧化钠溶液 | 生成沉淀的质量 |
| A. | A | B. | B | C. | C | D. | D |
5.下列物质中不属于合金的是( )
| A. | 硬铝 | B. | 不锈钢 | C. | 硅钢 | D. | 氧化汞 |
15.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动,请你和他们仪器完成以下实验探究.
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,该反应的化学方程式是Ca(OH)2+2HCl=CaCl2+2H2O.
【查阅资料】CaCl2溶液显中性
【提出问题】实验中未观察到明显显像,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;
猜想Ⅱ:有CaCl2和HCl;
猜想Ⅲ:有CaCl2和Ca(OH)2;
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是盐酸和氢氧化钙不能共存.
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想Ⅲ是正确的.
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因碳酸钠与氯化钙也能产生碳酸钙白色沉淀.
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余.
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,该反应的化学方程式是Ca(OH)2+2HCl=CaCl2+2H2O.
【查阅资料】CaCl2溶液显中性
【提出问题】实验中未观察到明显显像,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;
猜想Ⅱ:有CaCl2和HCl;
猜想Ⅲ:有CaCl2和Ca(OH)2;
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是盐酸和氢氧化钙不能共存.
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究.
| 实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
| 实验操作 | 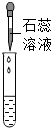 | 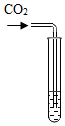 | 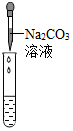 |
| 实验现象 | 溶液变为蓝色 | 溶液变浑浊 | 产生白色沉淀 |
| 实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因碳酸钠与氯化钙也能产生碳酸钙白色沉淀.
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余.
2.氯化钠俗名食盐是工业生产和生活的一种重要原料,也是实验室里常见的一种药品.下表是20℃时,氯化钠溶解于水的实验数据,回答下列问题;
(1)表中 m=13.6;
(2)在这4次实验中,得到的是20℃氯化钠溶液属于饱和溶液的是③④(填实验序号)
(3)计算第3次实验得到的氯化钠溶液的溶质质量分数.(写出过程)
(4)20℃时,实验室把100克溶质质量分数为20%的氯化钠溶液释成5%的氯化钠溶液,需加水多少毫升?(写出过程)
| 实验序号 | 水的质量(g) | 加入氯化钠的质量(g) | 溶液的质量(g) |
| ① | 10 | 2 | 12 |
| ② | 10 | 3 | 13 |
| ③ | 10 | 4 | 13.6 |
| ④ | 10 | 5 | m |
(2)在这4次实验中,得到的是20℃氯化钠溶液属于饱和溶液的是③④(填实验序号)
(3)计算第3次实验得到的氯化钠溶液的溶质质量分数.(写出过程)
(4)20℃时,实验室把100克溶质质量分数为20%的氯化钠溶液释成5%的氯化钠溶液,需加水多少毫升?(写出过程)
19.在一个密闭的容器中有甲、乙、丙、丁四种物质,在一定条件充分反应,测得反应前后各物质的质量如表,下列正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 3 | 8 | 5 | 4 |
| 反应后质量/g | X | 2 | 5 | 6 |
| A. | 待测值X=4 | |
| B. | 该反应为化合反应 | |
| C. | 丙一定是该反应的催化剂 | |
| D. | 反应过程中甲和丁变化的质量比为2:1 |
20.探究实验的设计对化学研究很重要,下列实验设计能达到探究目的是( )
| A. | 探究CO2和水反应:把干燥的石蕊纸花和湿润的石蕊纸花分别放到盛CO2的集气瓶中 | |
| B. | 探究铁生锈的条件:把洁净的铁钉分别放在干燥的试管里和半浸在水的试管里 | |
| C. | 探究质量守恒:在密闭的容器内用硫酸钠和稀盐酸反应 | |
| D. | 探究分子的运动:用大烧杯把分别盛有浓盐酸和酚酞溶液的小烧杯罩在一起 |