题目内容
2.工业上通常用黄铁矿(主要成分FeS2)为原料生产硫酸,先将黄铁矿粉碎,然后按照以下流程制备硫酸: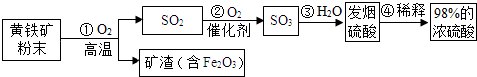
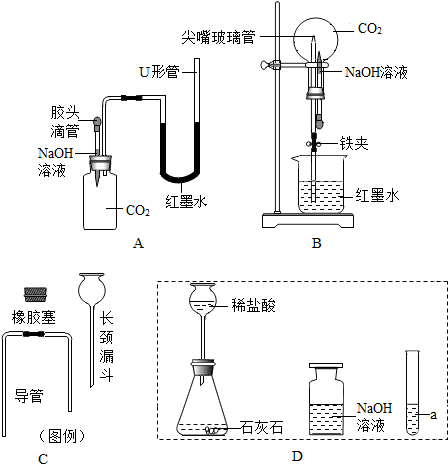
(1)判断下列说法不正确的是c(选填序号字母)
a.将黄铁矿粉碎的目的,是增大反应物的接触面积 b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO3的产量 d.排出的矿渣可供炼铁
(2)写出实验室稀释浓硫酸的具体操作步骤将浓硫酸沿烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌..
(3)过程②的化学方程式为2SO2+O2$\frac{\underline{\;催化剂\;}}{\;}$2SO3.
(4)取10g矿渣样品(含Fe2O3),向其中加入150g溶质质量分数为9.8%的稀硫酸(已知矿渣中的Fe2O3与稀硫酸恰好完全反应得到Fe2(SO4)3溶液),试通过化学方程式计算该矿渣样品中Fe2O3的质量分数.
分析 (1)a、将矿石粉碎,能增大反应物的接触面积;
b、过量空气中能带来较多的氧气,能提高SO2的转化率;
c、根据催化剂的特点分析;
d、根据矿渣中含有氧化铁分析.
(2)根据稀释浓硫酸的方法回答;
(3)根据反应写出反应的化学方程式.
(4)根据氧化铁与硫酸反应的方程式,由硫酸的质量求出氧化铁的质量,再求出氧化铁的质量分数.
解答 解:(1)a.将黄铁矿粉碎的目的,是增大反应物的接触面积,故a说法正确;
b.过量空气带来较多的氧气,能提高SO2的转化率,故b正确;
c.使用催化剂能改变反应的速率等,不能提高SO3的产量,故c错误;
d.排出的矿渣中含有氧化铁,可供炼铁,故d正确;
(2)稀释浓硫酸时:将浓硫酸沿烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌.
(3)过程②中二氧化硫和氧气在催化剂的作用下生成了三氧化硫,化学方程式为2SO2+O2$\frac{\underline{\;催化剂\;}}{\;}$2SO3;
(4)150g9.8%的稀硫酸中含H2SO4的质量是:150g×9.8%=14.7g
设氧化铁的质量为x
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
160 294
x 14.7g
$\frac{160}{294}=\frac{x}{14.7g}$ 解得:x=8g
该矿渣样品中Fe2O3的质量分数为:$\frac{8g}{10g}×100%$=80%.
故答为:(1)C;(2)将浓硫酸沿烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌;(3)2SO2+O2$\frac{\underline{\;催化剂\;}}{\;}$2SO3;(4)该矿渣样品中氧化铁的质量分数为80%.
点评 解答本题的关键是知道反应物接触面积越大,反应越剧烈;熟悉方程式的书写注意事项;知道浓硫酸的稀释方法等知识.



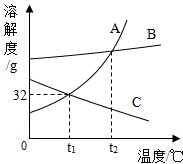 如图是A、B、C三种固体物质溶解度曲线.
如图是A、B、C三种固体物质溶解度曲线.