题目内容
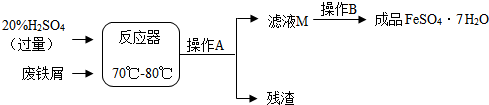
8. 某化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用2g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水),得到如表部分数据和图象.
某化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用2g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水),得到如表部分数据和图象. | 稀盐酸的用量 | 第一次5g | 第二次5g | 第三次5g |
| 剩余固体的质量 | 1.5g | ng | 0.5g |
(2)求该稀盐酸的溶质质量分数.
(3)求此石灰石中碳酸钙的质量分数.
分析 第一次加入5g稀盐酸后,剩余固体的质量是1.5g,反应的碳酸钙质量为:2g-1.5g=0.5g,说明5g稀盐酸能和0.5g碳酸钙恰好完全反应;
第二次加入5g稀盐酸后,如果碳酸钙足量,剩余固体的质量应该为:1.5g-0.5g=1g;
第三次加入5g稀盐酸后,剩余固体的质量是0.5g,说明第二、三次实验中所用稀盐酸已反应完全;
再根据表中提供的数据可以进行相关方面的计算.
解答 解:解:(1)第一次加入5g稀盐酸后,剩余固体的质量是1.5g,反应的碳酸钙质量为:2g-1.5g=0.5g,说明5g稀盐酸能和0.5g碳酸钙恰好完全反应;
第二次加入5g稀盐酸后,如果碳酸钙足量,剩余固体的质量应该为:1.5g-0.5g=1.0g;即表中n的数值应为1.0g;故填:1.0g;
(2)设5g稀盐酸中氯化氢质量为x,
因为第1次反应中稀盐酸完全反应,因此利用第1次反应过程进行计算,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73
0.5g x
$\frac{100}{0.5g}=\frac{73}{x}$
x=0.365g,
所用稀盐酸的溶质质量分数为:$\frac{0.365g}{5g}×100%$=7.3%,
(3)设,石灰石中碳酸钙的质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73
y 17g×7.3%
$\frac{100}{y}=\frac{73}{17×7.3%}$
y=1.7g
此石灰石中碳酸钙的质量分数为:$\frac{1.7g}{2g}×100%$=85%.
答:所用稀盐酸的溶质质量分数为7.3%;
此石灰石中碳酸钙的质量分数为85%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,同时考查了分析数据的能力,计算时要注意规范性和准确性.

 初中暑期衔接系列答案
初中暑期衔接系列答案| A. | 氧分子和硫分子 | B. | 氧原子和硫原子 | C. | 氧分子和硫原子 | D. | 二氧化硫分子 |
| A. | 酸雨 | B. | 白色污染 | C. | 臭氧层破坏 | D. | 温室效应 |
| A. | 氧化镁MgO2 | B. | 氯化锌ZnCl | C. | 碳酸钾KCO3 | D. | 硝酸银AgNO3 |
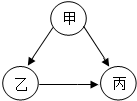 甲、乙、丙为初中化学常见的物质,它们之间存在如图所乐的转化关系(在一定条件下均能一步实现).下列说法不正确的是( )
甲、乙、丙为初中化学常见的物质,它们之间存在如图所乐的转化关系(在一定条件下均能一步实现).下列说法不正确的是( )| A. | 若甲、乙组成元素相同,丙为气体单质,则丙可以是O2 | |
| B. | 若甲、乙、丙分别为CO2、CO、C中的一种,甲→丙的基本反应类型可以有两种 | |
| C. | 若甲、乙、丙分别为Ca0、CaCl2、Ca(0H)2的一种,实现图中转化,另外加入的物质至少要三种 | |
| D. | 若甲、乙、丙分别为NaCl、NaN03、Na2SO4溶液的一种,每步转化中,都有两离子数目要减少 |
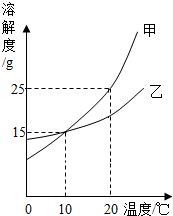 如图是甲、乙两种固体物质的溶解度曲线图,请回答下列问题:
如图是甲、乙两种固体物质的溶解度曲线图,请回答下列问题: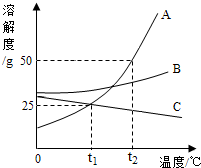 如图是A、B、C三种物质的溶解度曲线.
如图是A、B、C三种物质的溶解度曲线.