题目内容
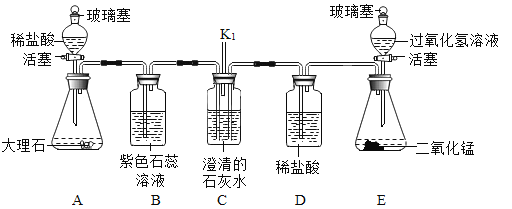
【题目】如图是一种利用二氧化碳生产甲醇的反应微观示意图(条件省略,![]() 表示碳原子,
表示碳原子,![]() 表示氧原子,
表示氧原子,![]() 表示氢原子):
表示氢原子):
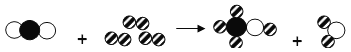
根据图,下列说法正确的是( )
A. 反应中共有三种分子
B. 反应中共有三种氧化物
C. 反应前后各元素化合价均不变
D. 甲醇是有机化合物
【答案】D
【解析】
由微观反应示意图可知,该反应的化学方程式为CO2+3H2=CH3OH+H2O。
A、反应中共有四种分子,故A错误;
B、氧化物是由两种元素组成的化合物,其中含有氧元素,所以只有水和二氧化碳两种氧化物,故B错误;
C、反应物氢气中的氢元素显0价,在生成的化合物中,氢元素显+1价,故C错误;
D、甲醛的化学式为CH3OH,是含有碳元素的化合物,属于有机化合物,故D正确。故选D。

 阅读快车系列答案
阅读快车系列答案【题目】在学完酸碱盐的知识后,某兴趣小组开展了如下的探究,请回答相关问题。
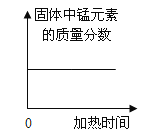
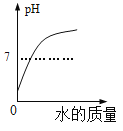
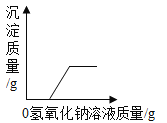
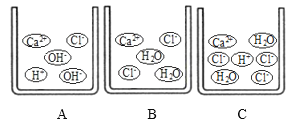
(1)向石灰乳中加入一定量的稀盐酸,得到了澄清溶液,写出发生反应的化学方程式:__________________________。已知氯化钙溶液显中性,现用pH计测得反应后的溶液的pH=4.3,则此时溶液里的粒子示意图正确的是_______(填字母序号)。
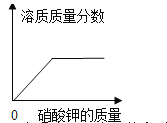
(2)已知常温下氢氧化钙的溶解度为 0.17g。若将石灰乳静置一段时间,则得到的上层澄清液体的溶质质量分数为_____(精确到 0.01%)。
(3)向石灰石中加入稀硫酸,发现反应缓慢,如何提高该反应速率呢?
查阅资料:石灰石与稀硫酸反应生成 CaSO4,同时产生CO2气体;且CaSO4 微溶于水。
Ⅰ.甲同学认为可以用增大稀硫酸浓度的方法来提高该反应速率。取相同质量相同规格的石灰石进行了如下实验:
实验 | ①10%硫酸溶液 | ②20%硫酸溶液 | ③40%硫酸溶液 |
观察1分钟内石灰石表面的气泡放出快慢 | 缓慢 | 明显加快 | 开始很快、又迅速变慢 |
由上述实验现象可知,增大稀硫酸的浓度_____(填“一定”或“不一定”)能提高该反应速率。请推测出现实验③中现象的原因:______________________________
Ⅱ.写出另外一种提高该反应速率方法:_____________________________。
【题目】如图是测定某赤铁矿粉中Fe2O3质量分数的实验装置:
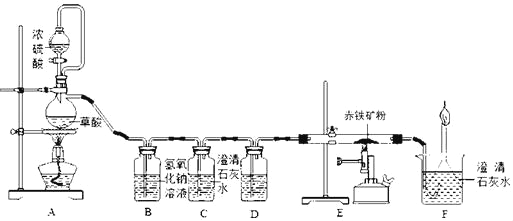
(1)A装置的作用是制取一氧化碳,反应的化学方程式为H2C2O4 =CO2↑+CO↑+H2O.根据反应装置判断,化学方程式中还缺少的条件是_____。
(2)C装置的作用是_____,D装置中药品的名称是_____,E装置中发生反应的化学方程式为_____,F处将尾气燃烧掉的目的是_____。
(3)实验过程中应该先点燃A处还是E处的加热装置?_____。
(4)实验中记录的数据如下表,据此计算赤铁矿中氧化铁的质量分数为_____。
玻璃管质量 | 玻璃管和药品反应前质量 | 玻璃管和药品反应后质量 |
71.8g | 81.8g | 79.4克 |
(5)有同学提出可以根据F装置中增加的质量来计算赤铁矿中氧化铁的质量,你同意此看法吗?说出你的观点和理由是_____。
【题目】小金为探究铁制品锈蚀的条件,进行如下实验:
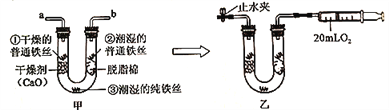
步骤1:利用图甲所示装置,将干燥的O2从导管a通入U形管(装置气密性良好.药品如图所示);待U形管内充满O2后,在导管b处连接一活塞推至底部的注射器,收集20mLO2后在导管a处连接乳胶管并用止水夹夹紧,如图乙所示。
步骤2:一段时间后,观察U形普内的铁丝其现象如表所示。
观察对象 | 现象 |
①干燥的普通铁丝 | 没有明显变化 |
②潮湿的普通铁丝 | 较多红褐色锈斑 |
③潮湿的纯铁丝 | 没有明显变化 |
(1)步骤1中,检查U形管内是否已充满O2的方法是_______。
(2)铁制品锈蚀的条件之一是需要 O2,在此实验中能支持此条件的证据是_____。
(3)通过对比实险现象,此实验还可得出铁制品锈蚀的条件是________。