题目内容
17.在实验室用一下装置进行氧气的制取和性质实验
(1)仪器a的名称是酒精灯
(2)实验室用氯酸钾和二氧化锰制取氧气时,发生装置应选用A(填字母),其反应的文字表达式为氯酸钾$→_{加热}^{二氧化锰}$氯化钾+氧气,该反应的基本类型是分解反应;若用过氧化氢的溶液和二氧化锰制取氧气,发生装置应选用B(填字母).
(3)实验室可用C装置收集氧气的原因是氧气的密度比空气的密度大,验满的方法为将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了;应将收集满氧气的集气瓶正(填“正”或“倒”)放在桌面上
(4)军军用装置E做实验时,没有看到细铁丝“剧烈燃烧,火星四射”的现象,你认为实验失败的可能原因是(至少写两条)①没有等到气泡均匀连续冒出就收集;②细铁丝上有锈等.
分析 制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了.应将收集满氧气的集气瓶正放在桌面上;军军用装置E做实验时,没有看到细铁丝“剧烈燃烧,火星四射”的现象,原因是:没有等到气泡均匀连续冒出就收集;细铁丝上有锈;铁丝不够细等.
解答 解:(1)酒精灯是常用的加热仪器,故答案为:酒精灯;
(2)如果用双氧水和二氧化锰制氧气就不需要加热,如果用氯酸钾制氧气就需要加热,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,属于分解反应;故答案为:A; 氯酸钾$→_{加热}^{二氧化锰}$氯化钾+氧气;分解反应;B;
(3)氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了;应将收集满氧气的集气瓶正放在桌面上;故答案为:氧气的密度比空气的密度大;将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了;正;
(4)军军用装置E做实验时,没有看到细铁丝“剧烈燃烧,火星四射”的现象,原因是:没有等到气泡均匀连续冒出就收集;细铁丝上有锈;铁丝不够细等;故答案为:没有等到气泡均匀连续冒出就收集;
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
2.科学兴趣小组的同学们对蛋壳的成分开展了有关探究.同学们的实验过程如下:
①将一定量的蛋壳放入容器中;②往其中加入适量的稀盐酸,观察到有较多的气泡产生;③…;④得出结论:蛋壳的主要成分是碳酸盐.
(1)请补全第③步的实验内容与现象将收集的气体通入澄清的石灰水,澄清的石灰水变浑浊.
(2)为了测定蛋壳中碳酸钙的质量分数,同学们用蛋壳与足量的稀盐酸充分反应,得到有关数据如表:(CO2的密度为2克/升)
请你通过列式计算蛋壳中碳酸钙的质量分数.
①将一定量的蛋壳放入容器中;②往其中加入适量的稀盐酸,观察到有较多的气泡产生;③…;④得出结论:蛋壳的主要成分是碳酸盐.
(1)请补全第③步的实验内容与现象将收集的气体通入澄清的石灰水,澄清的石灰水变浑浊.
(2)为了测定蛋壳中碳酸钙的质量分数,同学们用蛋壳与足量的稀盐酸充分反应,得到有关数据如表:(CO2的密度为2克/升)
| 蛋壳的质量(克) | 加入稀盐酸质量(克) | 收集到CO2气体体积(升) |
| 7.5 | 100 | 1.1 |
6.兴趣小组同学发现实验台上整齐摆放的药品中(如图),有一试剂瓶的标签破损.
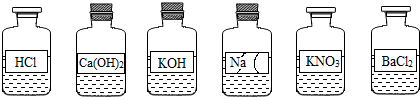
【提出问题】这瓶试剂的成分是什么?
(1)【讨论】根据受损标签及实验室药品分类摆放的原则,这瓶试剂不可能是酸.
A.酸 B.碱 C.盐
【猜想】①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是NaHCO3或Na2SO4或NaCl(任写一种).
(2)【设计并实验】
小明用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=10,他判断这是一种碱性溶液.对他的操作方法、测量结果及结论的评价,正确的是B.
A.方法正确,结果正确,且结论正确 B.方法不正确,结果偏小,但结论正确
C.方法不正确,结果偏大,结论不正确 D.方法正确,结果正确,但结论不正确
(3)小明认为它是NaOH溶液,小俊认为它是Na2CO3溶液.要进一步确定它的成分,小俊认为只需选择上图已有的试剂就能把它鉴别出来.他们又进行了实验.

【提出问题】这瓶试剂的成分是什么?
(1)【讨论】根据受损标签及实验室药品分类摆放的原则,这瓶试剂不可能是酸.
A.酸 B.碱 C.盐
【猜想】①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是NaHCO3或Na2SO4或NaCl(任写一种).
(2)【设计并实验】
小明用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=10,他判断这是一种碱性溶液.对他的操作方法、测量结果及结论的评价,正确的是B.
A.方法正确,结果正确,且结论正确 B.方法不正确,结果偏小,但结论正确
C.方法不正确,结果偏大,结论不正确 D.方法正确,结果正确,但结论不正确
(3)小明认为它是NaOH溶液,小俊认为它是Na2CO3溶液.要进一步确定它的成分,小俊认为只需选择上图已有的试剂就能把它鉴别出来.他们又进行了实验.
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中 取样于试管中 滴加稀盐酸(或氯化钡溶液) | 产生气泡 (或产生白色沉淀) | 猜想②正确 相关的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑ Na2CO3+BaCl2=BaCO3↓+2NaCl |


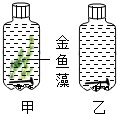 如图所示,玻璃瓶中都装满冷开水,并加入碳酸氢钠(一种二氧化碳释放剂).将装置置于光照条件下,一段时间后,判断甲、乙两瓶中哪枚铁钉先出现锈迹,并说明理由.
如图所示,玻璃瓶中都装满冷开水,并加入碳酸氢钠(一种二氧化碳释放剂).将装置置于光照条件下,一段时间后,判断甲、乙两瓶中哪枚铁钉先出现锈迹,并说明理由.