题目内容
5.善于提出问题、探究问题和解决问题是学好化学的重要方法,某研究性学习小组的同学在学习铁及其化合物知识时进行了系列研究.
【提出问题】
问题1:铁为何称为黑色金属?
问题2:铁和氧气在不同条件下能发生哪些反应?
问题3:铁有多种氧化物,它们的性质有哪些差异?
问题4:钢铁厂在选矿时,如何测定铁矿石中的含铁量?
问题5:用一氧化碳还原氧化铁得到的黑色固体一定是单质铁吗?
Ⅱ.解决问题
【问题1】上网查寻,有两种说法
a.因为在铁表面有黑色的铁的氧化物,所以叫黑色金属
b.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属
(1)你认为正确的说法是a(填“a”或“b”)
【问题2】通过学习,已经知道铁丝在潮湿的空气中能生锈,也能在纯氧中燃烧.
(2)请写出一种防止钢铁生锈的方法刷漆;
(3)请写出铁丝在纯氧中燃烧的化学方程式3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
【问题3】查阅资料:a.铁常见的氧化物有氧化铁(Fe2O3)、四氧化三铁(Fe3O4)和氧化亚铁(FeO).
b.四氧化三铁是具有磁性的黑色晶体,可以近似地看怍是氧化亚铁和氧化铁的化合物.它不溶于水,能与酸反应生成两种盐.
c.氧化亚铁是不溶于水的黑色粉末,能与酸反应,无磁性,也不能被磁铁吸引.
(4)请写出四氧化三铁与盐酸反应的化学方程式Fe3O4+8HCl=FeCl2+2FeCl3+4H2O.
【问题4】同学们参观了某钢铁厂,了解到钢铁厂在选矿时测定铁矿石中含铁量的方法较多,小明结合所学知识,设计了如图1所示的实验装置测定某赤铁矿样品中Fe203的质量分数.他称取l0.0g赤铁矿,当赤铁矿中的Fe2O3全部还原为Fe时,剩余固体在CO的保护下冷却、称量.质量为7.6g(假设赤铁矿中的杂质均不与CO反应)
(5)图中酒精灯的作用是将多余的CO气体通过燃烧除掉,防止空气的污染.
(6)该赤铁矿中Fe203的质量分数为80%(列出计算过程).
【问题5】在钢铁厂的实验室.同学们采集了用某种热分析仪记录的C0与Fe203进行反应时的有关数据,并得到固体质量与反应温度的关系曲线.如图2所示.
(7)根据图象分析,写出P点时固体成分的化学式Fe.固体质量由48.0g变为46.4g的过程中发生反应的化学方程式为3Fe2O3 +CO$\frac{\underline{\;400-500℃\;}}{\;}$2Fe3O4+CO2.
分析 (1)铁是在高温下炼制成,高温下会和空气中的氧气反应生成四氧化三铁或氧化亚铁,颜色都是黑色氧化物,氧化铁是红色氧化物,常温下缓慢氧化或电化腐蚀生成得到,氧化铁为红色,四氧化三铁为黑色;
(2)防止铁生锈就是使铁与水或氧气隔绝;
(3)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可;
(4)根据四氧化三铁可以近似地看怍是氧化亚铁和氧化铁的化合物.能与酸反应生成铁盐和亚铁盐;
(5)根据一氧化碳有毒分析;
(6)根据反应前后质量变化利用质量差法分析Fe203的质量,进而计算该赤铁矿中Fe203的质量分数;
(7)根据氧化性:Fe2O3>Fe3O4>FeO判断与CO反应的先后顺序,然后判断反应温度800℃(P点)时残留固体的成分;根据氧化性顺序及温度判断固体质量由48.0g变为46.4g时参加反应的物质及生成物,然后写出反应的化学方程式.
解答 【解答】解:(1)由于氧化铁为红色,四氧化三铁为黑色,则b的说法不正确,a说法正确.
(2)防止铁生锈就是使铁与水或氧气隔绝,可以采用涂油或刷漆的方法等.
(3)铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
(4)由于四氧化三铁可以近似地看怍是氧化亚铁和氧化铁的化合物,所以四氧化三铁与盐酸反应生成氯化铁、氯化亚铁和水,化学方程式为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O.
(5)由于CO有毒,不能直接排放,应该在排放尾气的导气管口放一盏燃着的酒精灯,将多余的CO气体通过燃烧除掉..
(6)设该赤铁矿中Fe203的质量为x
Fe2O3 +3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,质量减少
160 112 160-112=48
x l0.0g-7.6g=2.4g
$\frac{160}{48}=\frac{x}{2.4g}$ x=8g
该赤铁矿中Fe203的质量分数为:$\frac{8g}{10g}$×100%=80%;
(7))根据氧化性Fe2O3>Fe3O4>FeO可知,与CO发生反应时,Fe2O3优先反应,然后Fe3O4反应,最后FeO反应,根据图象曲线可知,加热到800℃时三种氧化物反应完全,此时固体为Fe;
固体质量由48.0g变为46.4g时,对应温度为400-500℃,根据氧化性Fe2O3>Fe3O4>FeO可知,此时是Fe2O3与CO反应,与CO发生反应时.失去氧48g-46.4=1.6g
氧化铁中氧元素为48×$\frac{48}{160}$=14.4g,铁元素质量=48-14.4g=33.6g,
残余固体中氧元素质量=14.4g-1.6g=12.8g
铁氧原子个数比=(33.6/56):(12.8/16)=3:4,所以此时还原产物为Fe3O4,对应方程式是:3Fe2O3 +CO$\frac{\underline{\;400-500℃\;}}{\;}$2Fe3O4+CO2.
故答案为:(1)a;
(2)刷漆;
(3)3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
(4)Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;
(5)将多余的CO气体通过燃烧除掉,防止空气的污染;
(6)80%;
(7)Fe;3Fe2O3 +CO$\frac{\underline{\;400-500℃\;}}{\;}$2Fe3O4+CO2.
点评 本题考查了物质的检验与鉴别方法、铁及其氧化物的性质等知识,题目难度较大,注意掌握常见金属单质及其化合物性质,明确物质检验与鉴别的实验方案的设计方法.

 阅读快车系列答案
阅读快车系列答案| A. | 用锅盖盖灭着火的油锅. | B. | 用二氧化碳灭火器灭火 | ||
| C. | 砍掉树木形成隔离带 | D. | 消防队员用高压水枪灭火 |
 下列数据是硝酸钾和氯化钠在不同温度时的溶解度.
下列数据是硝酸钾和氯化钠在不同温度时的溶解度.| 温度/℃ | 10 | 30 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
(2)从NaCl溶液中得到NaCl晶体的方法是蒸发结晶;
(3)40℃时,氯化钠的溶解度小于(填“无法确定”、“大于”、“小于”)硝酸钾的溶解度;
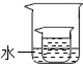
(4)如图所示,小烧杯中盛放的是上述(1)中所得的硝酸钾溶液.若将少量的下列物质,分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是AC(填字母).
A.冰 B.浓硫酸 C.硝酸铵 D.氢氧化钠.
| A. | 二氧化碳 | B. | 二氧化硫 | C. | 一氧化碳 | D. | 可吸入颗粒物 |
| A. | 寻找新的催化剂使水变成油 | |
| B. | 测定空气中氧气含量的实验,用白磷代替红磷 | |
| C. | 用燃着的木条检验二氧化碳 | |
| D. | 通过加高烟囱排放工业废气,防止空气污染 |
| A. | (NH4)2SO4 | B. | KNO3 | C. | Ca3(PO4)2 | D. | KCl |
| A. | ①③④ | B. | ②④⑤ | C. | ①②③④ | D. | ①③⑤ |
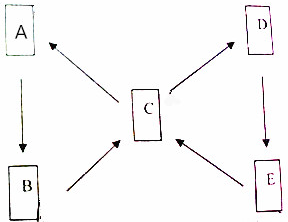 A、B、C、D、E都是含铜元素的物质,其中,A为单质,其它都是铜的化合物且铜元素在这些化合物中都显+2价,B为黑色物质,C为一种硫酸盐且为蓝色溶液,D和胃液中的酸含有一种相同的元素,E为蓝色沉淀,它们的转化关系如图所示,请你结合信息推断:
A、B、C、D、E都是含铜元素的物质,其中,A为单质,其它都是铜的化合物且铜元素在这些化合物中都显+2价,B为黑色物质,C为一种硫酸盐且为蓝色溶液,D和胃液中的酸含有一种相同的元素,E为蓝色沉淀,它们的转化关系如图所示,请你结合信息推断: